1、简答题 如图各物质是中学化学中常见的物质,甲和A的焰色反应为黄色,常温常压下B为无色无味气体,丁可使带火星的木条复燃.请回答下列问题:
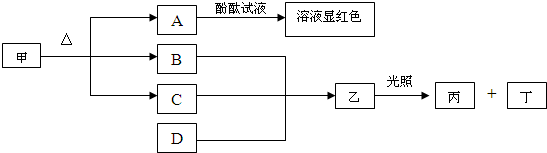
(1)写出B的电子式______.
(2)工业上生产D采用石灰乳与某种气体反应.D常用作______剂
(3)写出由A变甲的化学方程式______.
(4)B与甲烷在一定条件下生成氢气和CO的化学方程式______.
参考答案:丁可使带火星的木条复燃,应为O2,结合乙在光照条件下分解的性质可知乙为HClO,丙为HCl,甲和A的焰色反应为黄色,说明都含有Na元素,且A的水溶液呈碱性,可说明甲为NaHCO3,A为Na2CO3,则B为CO2,C为H2O,工业上生产D采用石灰乳与某种气体反应,结合题给转化关系可知D应为Ca(ClO)2,
(1)由以上分析可知B为CO2,电子式为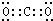 ,故答案为:
,故答案为: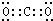 ;
;
(2)D为Ca(ClO)2,具有氧化性,可与酸反应生成具有漂白性的次氯酸,常用于漂白或消毒,
故答案为:漂白或消毒;
(3)Na2CO3可与CO2和水反应生成NaHCO3,反应的方程式为CO2+Na2CO3+H2O=2NaHCO3,
故答案为:CO2+Na2CO3+H2O=2NaHCO3;
(4)CO2与甲烷在一定条件下生成氢气和CO,二者发生氧化还原反应,反应的方程式为CO2+CH4=2CO+2H2,
故答案为:CO2+CH4=2CO+2H2.
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F、G各物质的相互转变关系如下图所示

已知:A是地壳里含量居第二位的元素。E可用G与O2充分反应制得。
(1)试推断以上各物质的化学式:
A_________B__________C__________D__________E__________F__________G________
(2)写出①②③反应的化学方程式
①_____________________________________________
②_____________________________________________
③_____________________________________________
参考答案:(1)Si;SiO2;Na2SiO3;H4SiO4;CO2;Na2CO3;C
(2)①SiO2+2NaOH=Na2SiO3+H2O;②SiO2+Na2CO3 Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
③Si+2NaOH+H2O=Na2SiO3+2H2↑
本题解析:
本题难度:一般
3、选择题 下列各组物质中,前者是单质,后者是氧化物的是
A.尿素、赤铁矿石
B.金刚石、水
C.液氧、氯酸钾
D.汞、碘酒
参考答案:B ?
本题解析:A项尿素为化合物,分子式为CO(NH2)2,赤铁矿石主要成分为Fe2O3,但为混合物;C项KClO3为三种元素组成的化合物,不属于氧化物;D项中碘酒为碘的酒精溶液,为混合物,故B项正确。
本题难度:一般
4、简答题 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
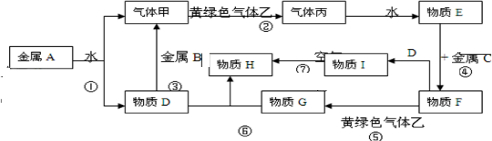
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______、C______、丙______;
(2)写出反应③的化学方程式______,
写出反应⑤的离子方程式______,
写出反应⑦的化学方程式______;
(3)冶炼金属A、B一般用______法,冶炼金属C一般用______法.
参考答案:黄绿色气体为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的D可能为碱,也可能为金属氧化物,但D能与金属B反应生成氢气,则D应为碱,为NaOH,所以A为Na,B为Al,盐酸与金属C反应,后还能继续与氯气反应,则金属C为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,I为Fe(OH)2,H为4Fe(OH)3,则
(1)由以上分析可知,A为Na,C为Fe,丙为?HCl,故答案为:Na;Fe;?HCl;
(2)反应③为Al和NaOH溶液的反应,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应⑤为Cl2和FeCl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Fe(OH)2具有还原性,能与空气中氧气反应生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2Fe2++Cl2=2Fe3++2Cl-;4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)Na、Al为活泼金属,应用电解法冶炼,Fe可用热还原法冶炼,故答案为:电解法;?热还原.
本题解析:
本题难度:一般
5、简答题 A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是______;工业上冶炼A的化学反应方程式是______.
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是______;1mol?C完全燃烧生成液态水时放热1300kJ,则C完全燃烧的热化学方程式是______.A与盐B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是______.
参考答案:(1)A是短周期中原子半径最大的元素构成的单质,应为Na,E既可溶于盐酸又可溶于NaOH溶液,应为Al(OH)3,
Al(OH)3与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,工业冶炼Na用电解熔融的NaCl的方法,反应的化学方程式为2NaCl(熔融)??电解?.??2?Na+Cl2↑,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;2NaCl(熔融)??电解?.??2?Na+Cl2↑;
(2)既含有极性键又含有非极性键的四原子分子有C2H2或H2O2,其中能燃烧的是C2H2,则A为CaC2,与水反应生成C2H2和Ca(OH)2,与B的溶液反应生成C2H2、水和碳酸钙,
则B为Ca(HCO3)2,
1molC2H2完全燃烧生成液态水时放热1300kJ,则2molC2H2完全燃烧放出2600kJ的热量,
所以完全燃烧的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600?kJ?mol-1,
故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2600?kJ?mol-1;Ca(HCO3)2.
本题解析:
本题难度:一般