1、选择题 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH =1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,, 则c(K+)为
[? ]
A. 0.15 mol·L-1
B. 0.2 mol·L-1
C. 0.3 mol·L-1
D. 0.4 mol·L-1
参考答案:C
本题解析:
本题难度:简单
2、选择题 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示。以下结论不正确的是(?)
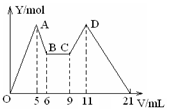
A.从6到9,相应离子反应方程式为H++OH-=H2O
B.A 是NaOH,B是盐酸,且c(NaOH):c( HCl) = 2:1
C.原混合液中,c(Al3+):c(Mg2+):c(Cl-) = 1:1:5
D.A是盐酸,B是NaOH, 且c(NaOH) =" 2c" (HCl)
参考答案:D
本题解析:由6mL和9mL对应液体中沉淀量相等,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故A正确;由图可知,5→6(1 mL)、9→11(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl.根据铝元素守恒:
NaOH-Al(OH)3-AlO2--H+
1? 1? 1? 1
由此可以推出:c(NaOH):c(HCl)=2:1,故B正确;从加入5 mL A生成沉淀最多,再继续加1 mL A沉淀量减少到最小值,相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10-3) mol;由前5 mL NaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3) mol;溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故C正确;根据加入前6 mL试剂时,先有沉淀生成而后溶解,所以,试剂A是NaOH,则B是盐酸,故D错误,答案选D。
点评:该题是中等难度的试题。试题综合性强,对学生的要求高,有利于培养学生的逻辑思维能力和创新思维能力,意在巩固学生的基础,提高学生的能力。能正确分析图象中转折线发生的化学反应是解本题的关键。
本题难度:一般
3、填空题 (6分)某学生为了测定由两种元素形成的气态化合物X的组成,进行了如图所示的实验,将装置内空气排尽后,把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应(气态化合物X与CuO均无剩余),得到如下结果:
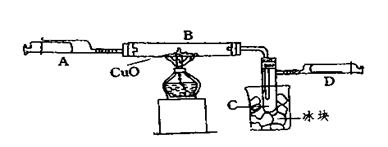
①实验前B管及药品的质量为21.32克,实验后为21.16克
②C管中收集到的物质电解后可得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14:3。问:
(1)C中收集到的液体,物质的量是 mol;
(2)在实验中看到的现象是 。
(3)B中反应的化学方程式是 。
参考答案:(1)0.01mol; (2)黑色固体逐渐变为红色;C管中有无色液体出现;D的内管向外推动。
(3)2NH3+3CuO 3Cu十N2↑+3H2O
3Cu十N2↑+3H2O
本题解析:(1)“D中收集到的是N2”,“C管中收集到的物质电解后可得到H2和O2”,根据这两个信息知道X中含有N、H两中元素,C是H2O,又有“X中两元素的质量比是14:3” 则可得氮、氧两种元素的原子个数比为1:3.所以X化学式为NH3; “由实验前B管及药品的质量为21.32g,实验后为21.16g”,可知B管质量减少了0.16g;减少的是O元素的质量,n(O)= 0.16g÷16g/mol="0.01mol" ,则收集到的水的物质的量为0.01mol;(2)根据以上分析知道氧化铜与氨气反应生成铜和水和氮气.所以现象为黑色固体逐渐变为红色,C管中生成水,冷却后变为无色液体,产生氮气,压强增大,注射器的内管向外推动;(3)根据以上分析,反应物为NH3和CuO,生成物为Cu、N2和H2O,则化学方程为:2NH3+3CuO 3Cu十N2↑+3H2O
3Cu十N2↑+3H2O
考点:物质组成的推测、实验现象的描述和物质的量的有关计算。。
本题难度:一般
4、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
A.0.25molNa2O2中含有的阴离子数为0.5×6.02×1023
B.7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023
C.2.24LCH4中含有的原子数为0.5×6.02×1023
D.250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023
参考答案:B
本题解析:属于常规题。A中阴离子为2Na+和1 O22—,故有0.25mol×3×6.02×1023;B中1molSiO2晶体中含有的硅氧键数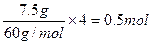 ,B对;C中没有标况;D错的很明显,NH3·H2O要电离。
,B对;C中没有标况;D错的很明显,NH3·H2O要电离。
本题难度:一般
5、选择题 下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是( )
A.150 mL 1 mol·L-1的NaCl
B.75 mL 2 mol·L-1的NH4Cl
C.150 mL 3 mol·L-1的KCl
D.75 mL 2 mol·L-1的CaCl2