1、选择题 下列有关金属的腐蚀与防护的说法中,不正确的是
A.温度越高,金属腐蚀速率越快
B.在铁管外壁上镀锌可防止其被腐蚀
C.金属被腐蚀的本质是金属发生了氧化反应
D.将钢闸门与直流电源的正极相连可防止其被腐蚀
参考答案:D
本题解析:升高温度加快反应速率,A正确;锌比铁活泼,和铁构成原电池时,锌是负极,铁是正极被保护,B正确;金属失去电子被氧化的过程是金属的腐蚀,C正确;和电源的正极相连,作阳极,失去电子加快腐蚀,D不正确,答案选D。
点评:金属腐蚀包括化学腐蚀和电化学腐蚀,且主要也是以电化学腐蚀为主。而金属的防护也主要是依据电化学原理,常用的方法是牺牲阳极的阴极保护法以及外接电流的以及保护法。
本题难度:一般
2、选择题 如右图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是(?)

A.电流表指针不发生偏转?
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH增加
D.Mg、C两极生成的气体在一定条件下可以恰好完全反应
参考答案:CD
本题解析:A 错 闭合开关S后,甲池是原电池,乙池是电解池,有电流通过,电流表指针偏转
B 甲池中Al和氢氧化钠溶液反应,做负极,Mg电极上有氢气产生。乙池中Pt做阴极,C做阳极,Pt电极有氢气产生
C 甲池氢氧化钠溶液参加了反应,所以,浓度减小,PH减小。乙池电解氢氧化钠溶液,本质是电解水,溶液浓度增大,PH增大。
D Mg极上产生氢气,C极上产生氧气,恰好完全反应,生成水。故选C、D。
本题难度:简单
3、选择题 下列说法正确的是
A.钢铁发生电化腐蚀的正极反应式:Fe-2e-="=" Fe2+[来
B.为实现铁上镀铜,可让铁做阳极.
C.粗铜精炼时,与电源正极相连的是纯铜
D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-==Cl2↑
参考答案:D
本题解析:A错,钢铁发生电化腐蚀的负极反应式:Fe-2e-="=" Fe2+;B错,为实现铁上镀铜,可让铁做阴极;C错,粗铜精炼时,与电源正极相连的是粗铜;D正确;
本题难度:一般
4、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是(?)
A.2H2O+O2+4e- 4OH-
4OH-
B.Fe2++2e- Fe
Fe
C.Fe3++e- Fe2+
Fe2+
D.4OH--4e- 2H2O+O2↑
2H2O+O2↑
参考答案:A
本题解析:钢铁发生吸氧腐蚀,正极上是氧气得电子被还原的反应:2H2O+O2+4e- 4OH-。
4OH-。
本题难度:一般
5、填空题 (1)[2013·四川理综,11(4)]以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是______________________________。
(2)[2013·重庆理综,11(2)]化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
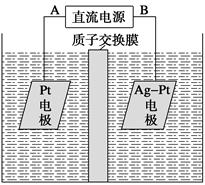
①电源正极为__________(填A或B),阴极反应式为__________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)[2013·新课Ⅱ,36(1)]锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图所示。
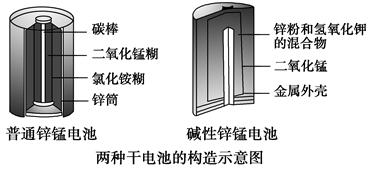
回答下列问题:
普通锌锰电池放电时发生的主要反应为
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是_____________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是________________。
参考答案:(1)Al+3NiO(OH)+NaOH+H2O===NaAlO2+3Ni(OH)2
(2)①A 2NO3—+6H2O+10e-===N2↑+12OH-
②14.4
(3)①Zn NH4Cl MnO2+NH4++e-===MnOOH+NH3 ②碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答对一条即可,其他合理答案也可)
本题解析:(1)该新型电池放电时,关键判断Al的氧化产物。由于NaOH溶液的存在,Al被氧化生成NaAlO2而不是Al(OH)3,故电池反应的化学方程式为:Al+3NiO(OH)+NaOH+H2O===NaAlO2+3Ni(OH)2。
(2)阴极:2NO3—+6H2O+10e-===N2↑+12OH-
阳极:10OH--10e-===5H2O+5/2O2↑
在阳极区生成的H+通过质子交换膜到达阴极区,所以,当电子过程中转移10 mol e-时,
Δm左=5/2mol×32 g·mol-1+10 g=90 g
Δm右=28 g-10 g=18 g
所以当转移2 mol e-时,膜两侧电解液的质量变化差为(90-18)/5=14.4 g。
(3)①该电池中,负极材料是较活泼的金属Zn,电解质的主要成分是NH4Cl,正极发生还原反应,电极反应为:MnO2+NH4++e-===MnOOH+NH3。②与普通锌锰电池相比,碱性锌锰电池不易发生电解质的泄漏,因为消耗的负极改装在电池内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
本题难度:简单