1、选择题 一定条件的密闭容器中:4NH3(g)+5O2(g)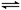 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述不正确的是
A.达到平衡时放出热量为905.9 kJ,则起始时投入4 mol NH3和5 mol O2
B.平衡时4v正(O2)=5v逆(NO)
C.平衡后降压,混合气体平均摩尔质量减小
D.NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等
参考答案:A
本题解析:因为是可逆反应,转化率不可能是100%的,参加反应的氨气和氧气分别是4mol和5mol,但最初投入的应该分别大于4mol和5mol,A不正确。反应速率之比是相应的化学计量数之比,B正确。降低压强,平衡向正反应方向移动,气体的总的物质的量增加,平均摩尔质量减小,C正确。如果反应物的起始量满足相应的化学计量数之比,则反应物的转化率一定是相同的,D正确,答案选A。
本题难度:简单
2、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应A(g) + 2B(g) C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.反应放出的热量
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C可以说明。该反应是体积减小的,则压强也是始终减小的,所以当压强不再发生变化时可以说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不能说明。同样当反应放出的热量不再发生变化时,也可以说明,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应方程式灵活运用即可。
本题难度:一般
3、选择题 反应4NH3(g)+ 5O2(g)= 4NO(g)+ 6H2O(g),在密闭容器中进行30分钟后,水蒸气的物质的量浓度增加了0.45mol/L,则此反应的平均反应速率可表示为
[? ]
A.v(NH3)=0.010mol/(L·min)
B.v(O2)=0.0010 mol/(L·min)
C.v(NO)=0.0010 mol/(L·min)
D.v(H2O)=0.0450 mol/(L·min)
参考答案:A
本题解析:
本题难度:简单
4、选择题 在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(气)+B(气)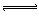 C(气)+D(气)
C(气)+D(气)
5 min后达到平衡。已知各物质的平衡浓度的关系为:
[A]a[B]=[C][D]</PGN0039A.TXT/PGN>
若在温度不变的情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为?
A.60%
B.40%
C.24%
D.4%
参考答案:B
本题解析:
容器体积扩大,但A转化率不变,可见反应前后总体积不变,因此a=1,方程式:
A(g)+ B(g) 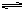 ?C(g)+? D(g)
?C(g)+? D(g)
起始量? 2? 3? 0? 0
变化量? x? x? x? x
平衡量? 2-x? 3-x? x? x
平衡时? [A][B]=[C][D]
∴(2-x)(3-x)=x2
∴x=1.2
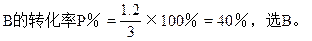
本题难度:一般
5、简答题 把0.6mol?X气体和0.6mol?Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min?末已生成0.2mol?W,若测知以Z的浓度变化表示的反应速率为0.1mol?L-1?min-1,请计算:
(1)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
(2)前2min内用X的浓度变化表示的平均反应速率.
参考答案:利用三段式法计算:
?2X(g)+Y(g)=nZ(g)+2W(g)
起始:0.6mol? 0.6mol?0? 0
转化:0.2mol? 0.1mol? 0.1nmol 0.2mol
平衡:0.4mol?0.5mol? 0.1nmol?0.2mol?
(1)平衡时Y的物质的量为0.5mol,则c(Y)=0.5mol2L=0.25mol/L,
答:2min末时Y的浓度为0.25?mol?L-1;
(2)v(W)=0.2mol2L2min=0.05mol/(L?min),c(Z)=0.1mol/(L?min),
由反应速率之比等于化学计量数之比可知:n:2=0.1mol/(L?min):0.05mol/(L?min),n=4,
答:化学反应方程式中n=4;
(3)由反应速率之比等于化学计量数之比可知:v(X)=v(W)=0.05mol/(L?min),
答:前2min内X的平均反应速率为0.05?mol?L-1?min-1.
本题解析:
本题难度:一般