1、选择题 某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X.则MX/VNA表示的是
A.以g为单位V L该气体的质量
B.以g为单位1 L该气体的质量
C.1 L该气体中所含的分子数
D.15.7 g混合物恰好与盐酸完全反应
2、计算题 恒温下,将amolN2与bmolH2的混合气体通入一个固定的密闭容器中。发生如下反应:
N2+3H2 2NH3
2NH3
(1)若反应进行到某时刻,n(N2)=13mol,n(NH3)=6mol,求a?
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25% ,
求b?
(3)达到平衡时,N2和H2的转化率之比为多少?
3、填空题 (14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  ?CO2(g)+H2(g)?
?CO2(g)+H2(g)?
某研究小组分别在体积均为2?L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
容器
编号
| 温度
/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡的时间/min
| 达平衡时体系能量的变化/kJ
|
CO
| H2O
| CO2
| H2
|
①
| 650
| 1
| 2
| 0.4
| 0.4
| 5
| 16.4kJ
|
②
| 650
| 2
| 4
| ?
| ?
| t1
| Q1 kJ
|
③
| 900
| 2
| 4
| 1.6
| 1.6
| t2
| Q2 kJ
|
(1)计算容器②中反应的平衡常数K=?(计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为?。
(3)容器①中反应达平衡这段时间,化学反应速率v (H2) =?。
(4)该反应的正反应为?(填“吸热”或“放热”)反应,理由是?。?
(5)下列叙述正确的是 ?(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1> 32.8 kJ
c.达到平衡的时间:t2> t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)  ?CO2(g)+H2(g)?△H=-41 kJ/mol
?CO2(g)+H2(g)?△H=-41 kJ/mol
(6)容器②中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,得到的溶液中所有离子的物质的量浓度由大到小的顺序为?。
4、选择题 某温度下,反应X(g)+3Y(g) 2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
2Z(g)的平衡常数为1 600。此温度下,在容积一定的密闭容器中加入一定量的X和Y,反应到某时刻测得各组分的浓度如下:
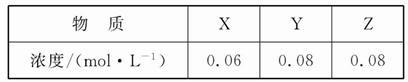
下列说法正确的是(? )
A.此时v(正)<v(逆)
B.平衡时Y的浓度为0.05 mol·L-1
C.平衡时X的转化率为40%
D.增大压强使平衡向正反应方向移动,平衡常数增大
5、选择题 工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
[? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应