1、选择题 将2molS02和1molO2放入一个密闭容器中,在一定的条件下反应到达“平衡状态”,此时,下列所示容器内存在各物质的物质的量中,一定不可能的是
A.0mol S02
B.1mol S02
C.2mol S03
D.0.3mol O2
参考答案:AC
本题解析:略
本题难度:简单
2、选择题 在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g) 3C(g)+2D(g),达到平衡状态的是
3C(g)+2D(g),达到平衡状态的是
A.混合气的平均相对分子质量不再改变?
B.反应器内A、B、C、D物质的量比为1:3:3:2
C.容器内密度不随时间变化而变化
D.生成 1mol A同时有3 mol C被消耗
参考答案:A
本题解析:A.混合气的平均相对分子质量等于气体的总质量除以总物质的量。根据质量守恒知,气体的总质量一直不变,而总物质的量只有达到平衡才会保持不变,所以混合气的平均相对分子质量不再改变能说明反应达到平衡状态。B,平衡时A、B、C、D物质的量之比不一定等于系数比,B错。C.气体的总质量一直保持不变,容器的容积也保持不变,所以容器内密度一直保持不变,C错。D.反应的任意时刻,生成 1mol A同时都会有3 mol C被消耗,D错。故选A
本题难度:一般
3、实验题 (11分)某研究性学习小组为证明2Fe3+ + 2I-  ?2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
?2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是?。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是?。
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到?现象,即可证明该反应为可逆反应,请解释产生该现象的原因?。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向?方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为?。
参考答案:(1)下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色。(2分)
(2)振荡过程中产物中的Fe2+离子被空气中氧气氧化。(2分)
方案乙:溶液从棕黄色变为无色(或变浅);(1分)
Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ + 2I-  ?2Fe2+ + I2平衡朝逆反应方向移动?(2分)
?2Fe2+ + I2平衡朝逆反应方向移动?(2分)
方案丙:左(2分);I2 +2e- = 2I-(2分)
本题解析:(1)根据实验数据可知碘化钾是过量的,若反应是可逆反应,则溶液中一定存在铁离子,同时也必须生成单质碘。所以可以通过检验铁离子和单质碘来证明。
(2)因为碘离子和亚铁离子在空气中也可以被氧气氧化生成单质碘和铁离子,所以方案不是很严密。
(3)可以依据外界条件对平衡的影响来验证。因为Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ + 2I-  ?2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
?2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
(4)在原电池中负极是失去电子的,碘离子失去电子,所以电子是从甲池流向乙池,所以电流计的指针向左偏转。
本题难度:一般
4、填空题 密闭容器A和B,A保持恒压,B保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量SO2和O2,发生反应:2SO2+O2 2SO3,并达平衡后。B容器中SO2的质量分数?(填“ >”、“ < ”或“=”) A 容器中SO2的质量分数
2SO3,并达平衡后。B容器中SO2的质量分数?(填“ >”、“ < ”或“=”) A 容器中SO2的质量分数
参考答案:>
本题解析:根据反应的方程式可知,正反应是体积减小的可逆反应,所以如果保持容器容积不变,则压强是减小的。因此在反应过程中,A中的压强大于B中的压强,所以A中SO2的转化率大于B中SO2的转化率,则B容器中SO2的质量分数大于A 容器中SO2的质量分数。
本题难度:一般
5、选择题 可逆反应2HI(g)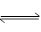 H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡(?)
H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡(?)
A.容器内压强
B.平均相对分子质量
C.各成分含量
D.混合气体颜色
参考答案:CD
本题解析:反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化。可逆反应2HI(g) H2(g)+I2(g)在密闭容器中进行,因为该反应是气体数不变的反应,故从反应开始到结束,容器的压强都不变,故A不能选;因为该反应是气体数不变的反应,故从反应开始到结束,容器内的平均相对分子质量不变,故B不能选;当各组分的含量和混合气体的颜色不随时间变化时,这说明了反应已经达到平衡,故本题的答案选择CD。
H2(g)+I2(g)在密闭容器中进行,因为该反应是气体数不变的反应,故从反应开始到结束,容器的压强都不变,故A不能选;因为该反应是气体数不变的反应,故从反应开始到结束,容器内的平均相对分子质量不变,故B不能选;当各组分的含量和混合气体的颜色不随时间变化时,这说明了反应已经达到平衡,故本题的答案选择CD。
点评:本题考查了化学平衡的知识,该知识点是高考考查的重点和难点,本题要掌握反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,这要根据具体反应具体分析,该题难度不大。
本题难度:一般