1、实验题 实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
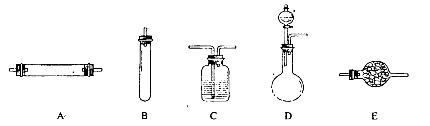
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.
2、实验题 用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
?①?→ 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ?②??→ 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序
| 第一次
| 第二次
| 第三次
| 第四次
|
初始读数(mL)
| 0.40
| 0.10
| 0.90
| 0.00
|
最终读数(mL)
| 25.05
| 20.10
| 21.00
| 19.90
|
V标(mL)
| 24.65
| 20.00
| 20.10
| 19.90
|
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________?
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
3、选择题 实验室欲快速制取氢气,应采取的措施是
A.用纯锌和稀硫酸反应
B.用含铜等的粗锌和稀硫酸反应
C.用纯锌和浓硫酸反应
D.用含铜等的粗锌和稀硝酸反应
4、实验题 .某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和?(填字母)。?
(2)写出步骤④中发生反应的离子方程式?。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2+? +? ClO3— +??= ?Fe3+?+? Cl— +? H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成?(填偏大、偏小或不影响),
(4)若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为?。(列出算式,不需化简)
5、选择题 下列关于层析实验的说法正确的是:
A.点样后应在滤纸上形成一个直径较大的样斑,便于实验时观察
B.展开剂可以既是流动相又是固定相
C.为使层析实验有较好的分离效果,试样溶液浓度应较小
D.纸层析法简称纸层析,是色谱分析法的一种