1、计算题 金属锡的纯度可以通过下述方法测定:将样品溶于盐酸Sn+2HCl=SnCl2+H2↑,再加过量的FeCl3溶液。发生如下反应:SnCl2+2FeCl3=SnCl4+2FeCl2,最后可用一定浓度的K2Cr2O7溶液滴定生成的Fe2+,此时还原产物为Cr3+。现有金属锡试样0.613g,经上述反应后,共用去0.1mol/L的K2Cr2O7的硫酸溶液16.0mL。⑴ 写出K2Cr2O7氧化Fe2+的离子方程式,并配平;⑵ 试样中锡的质量分数(假定杂质不参加反应)。
参考答案:
⑴ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O?⑵ 93.2%
本题解析:
略
本题难度:一般
2、简答题 某地有软锰矿和闪锌矿两座矿山,它们的组成如下:
软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;
闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分.
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示.
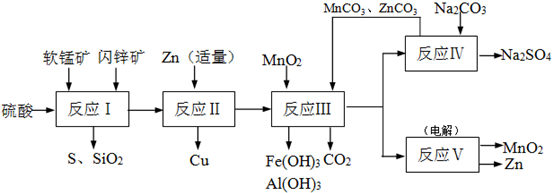
请回答下列问题:
(1)反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等.试完成反应Ⅰ中生成CuSO4和MnSO4的化学方程式:MnO2+CuS+______=______↓+______+CuSO4+______.
(2)反应Ⅱ加入适量锌的作用是______;如果锌过量,还会进一步发生反应的离子方程式为______.
沉淀物
Fe(OH)3
Al(OH)3
Zn(OH)2
开始沉淀pH
2.3
4.0
5.4
完全沉淀pH
4.1
5.2
8.0
|
(3)反应Ⅲ要调节pH生成Fe(OH)3、Al(OH)3,中过量的H+所使用的物质是______,调节的pH范围是______(pH数据见表).
(4)本工艺可以循环利用的物质有ZnCO3、MnCO3和______.
参考答案:(1)依据流程图分析判断,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,软锰矿和闪锌矿中的MnO2,CuS在酸性溶液中发生的氧化还原反应生成生成CuSO4和MnSO4硫单质,反应的化学方程式为:MnO2+CuS+2H2SO4=S↓+CuSO4+MnSO4+2H2O,
故答案为:2H2SO4;S;MnSO4;2H2O;
(2)流程分析,反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,加入锌反应生成铜,锌的主要作用是加入适量和铁离子反应生成亚铁离子,把铜离子转化为铜除去;锌过量会继续反应置换出铁;反应的离子方程式为:Zn+Fe2+=Fe+Zn2+,故答案为:将溶液中的硫酸铜转化为铜;Zn+Fe2+=Fe+Zn2+;
(3)反应Ⅲ要调节pH生成Fe(OH)3、Al(OH)3,依据图表分析PH在 5.2~5.4范围内铁离子和铝离子全部沉淀,锌离子不沉淀;由流程图可知加入碳酸锰和碳酸锌与溶液中的氢离子反应用来调节溶液PH使铁离子和铝离子沉淀,故答案为:MnCO3 、ZnCO3;5.2~5.4;
(4)依据流程图可知能循环使用的物质为ZnCO3、MnCO3和MnO2,故答案为:MnO2.
本题解析:
本题难度:一般
3、填空题 哈尔滨市场销售的某种食用精制盐包装袋上有如下说明
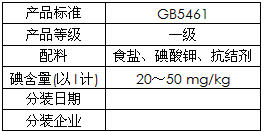
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_______________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是__________________________。
(3)已知:I2+2S2O32-== 2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是___________________。
②b中反应所产生的I2的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) _______________mg/kg。
参考答案:(1)1、5、3、3、3、3
(2)①I2+SO32-+H2O==2I-+2H++SO42-;②步骤后增加:将分液漏斗充分振荡后静置
(3)①溶液由蓝色恰好变为无色且半分钟内不恢复至原来颜色;②1×10-5;③
本题解析:
本题难度:一般
4、选择题 已知下列物质都能氧化H2S,它们氧化H2S时自身分别发生下列变化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是?
A.Fe3+
B.Br2
C.Cr2O72—
D.HNO3
参考答案:C
本题解析:由题目所给物质变化可知,Fe3+、Br2、Cr2O72—、HNO3可得到的电子数分别为1、2、6、3个,故氧化等物质的量的H2S气体得到S单质,需要上述离子或物质的物质的量最小的是Cr2O72—
本题难度:简单
5、选择题 水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O。下列说法中,不正确的是? ( )。
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1 mol O2参加反应,转移的电子总数为4 mol
参考答案:B
本题解析:由反应知还原剂是S2O32-,氧化剂是O2,每有1 mol O2参加反应,转移电子的物质的量为4 mol,A、D正确;由原子守恒知Y的化学式为Fe3O4,B错误;由电荷守恒知,a=4,C正确。
本题难度:一般