1、填空题 (6分)实验室用高锰酸钾和浓盐酸反应制取氯气:K^S*5U.C#O
KMnO4+ HCl — Cl2↑+ MnCl2+ KCl+ H2O
(1)配平上述的反应方程式,并标出电子转移的方向和数目(用双线桥)
(2)其中还原剂是_______。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是____mol。
参考答案:(6分) (1)配平2分,双线桥标电子转移的方向和数目2分
(1)配平2分,双线桥标电子转移的方向和数目2分
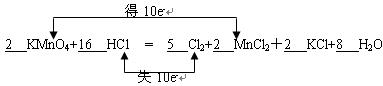
(2)HCl (1分)、0.5(1分)
本题解析:略
本题难度:简单
2、填空题 高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如下图:
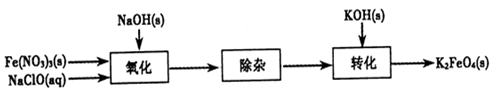
①完成氧化工序的离子方程式:
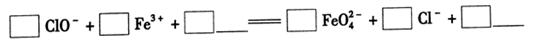
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4? (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。
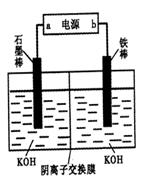
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
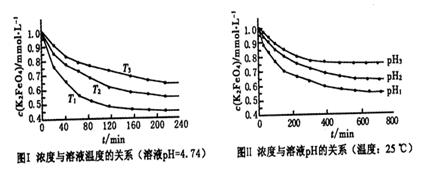
①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
参考答案:(1)杀菌和凝聚?(2)①ClO2-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O
②NaNO3、NaCl?③>?(3)①a?②Fe-6e-+8OH-=FeO42-+4H2O
(4)①>?②<
本题解析:(1)已知FeO42-+3e-+4H2O Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
(2)①根据方程式可知,反应中氯元素的化合价从+1价降低到-1价,得到2个电子。铁的化合价从+3价升高到+6价,得到2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是3:2。由于溶液显碱性,所以根据原子守恒可知,反应后还有水生成,则该反应的离子方程式为3ClO2-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O。
②根据原子守恒可知,反应中还有硝酸钠和氯化钠生成,所以除杂的目的是除去NaNO3、NaCl。
③根据该温度下高铁酸钠能转化为高铁酸钾,所以根据沉淀容易向更难的方向转化可知,高铁酸钠的溶解度大于高铁酸钾的溶解度。
(3)①电解法制取K2FeO4,则反应中铁应该是失去电子,所以铁是阳极,因此b是电源的正极,a是大于的负极。
②铁是阳极失去6个电子,因此阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。
(4)①由图I可知,温度T1首先达到平衡状态,这说明温度T1最高。但温度高K2FeO4溶液浓度越小,这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应,即该反应的△H>0。
②pH越小,溶液的酸性越强,则溶液中OH-越小,有利于平衡向正反应方向移动。所以根据图2可知pH1时K2FeO4溶液浓度最小,因此pH1小于pH3。
本题难度:困难
3、填空题 化学知识在各个领域应用广泛。如:
(1)2003年10月15日,我国成为世界上第三个将人送入太空的国家,这次载人航天发射使用
的“长征”二号火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮为氧化剂,燃烧主要产生CO2、N2等气体,放出的巨大能量把火箭送入太空。反应的化学方程式为:?。(2分)
(2)管道工人曾经用浓氨水检验氯气管道。如果氯气管道某处漏气,会出现白烟现象。氨与氯
气反应的化学方程式为:??。(2分)出现白烟现象的化学方程式为:??。(2分)
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。工业生产ClO2过程是将食盐
水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。反应的化学方程式为:?。(2分)
(4)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的。这一过程中发生反应的化学方
程式为:?。(2分)
(5)维生素C在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+。这说明维生素C具有?。(填“氧化性”或“还原性”)(2分)
参考答案:(1)C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑
(2)2NH3+3Cl2=N2+6HCl;NH3+HCl=NH4Cl
(3)2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(4)SiO2+4HF=SiF4↑+2H2O(5)还原性
本题解析:(1)偏二甲肼与四氧化二氮反应,产生CO2、N2和水,反应的化学方程式为C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O↑。
(2)氯气管道某处漏气,会出现白烟现象,说明有氯化铵生成。这是由于氯气具有氧化性能把氨气氧化生成氮气与氯化氢,氯化氢与氨气结合生成氯化铵而冒白烟,有关反应的化学方程式分别为2NH3+3Cl2=N2+6HCl、NH3+HCl=NH4Cl。
(3)氯酸钠与盐酸反应生成二氧化氯,根据化合价变化可知,一定还有氧化产物氯气生成,根据原子守恒可配平反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
(4)氢氟酸腐蚀玻璃的化学方程式为SiO2+4HF=SiF4↑+2H2O。
(5)维生素C能把Fe3+转变为易吸收的Fe2+,铁元素化合价降低作氧化剂,因此维生素C是还原剂,这说明维生素C具有还原性。
本题难度:一般
4、选择题 将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+
参考答案:
本题解析:
本题难度:一般
5、填空题 已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
;三种含氯元素的离子,其中C1O-、Cl两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
(1)t1前,氧化产物是______?(填化学式).
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:______.
(3)该石灰乳中含有Ca(OH)2的物质的量是______mol.
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是______(填字母).
A.NaCl、Cl2 B.NaCl、NaClO? C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
______Fe(OH)3+______ClO-+______OH-----______Fe+______Cl-+______H2O.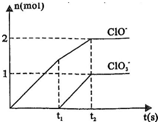
参考答案:(1)氧化还原反应在的氧化产物是还原剂被氧化生成的物质,化合价在变化中升高,即氯元素化合价升高生成的产物,结合图象分析,t1前,氧化产物只有Ca(ClO)2;故答案为:Ca(ClO)2;
(2)t2时,Ca(OH)2与C l2发生反应,依据图象分析可知生成次氯酸根和氯酸根离子物质的量之比为2:1,依据题干条件结合离子方程式的书写原则电荷守恒、原子守恒配平方程式,
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;
故答案为:5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;
(3)t2时,氢氧化钙和氯气恰好反应,依据反应的离子方程式可知:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;消耗氢氧化钙物质的量为:5mol;故答案为:5mol;
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,发生氧化还原反应,氯元素化合价从+3价升降,即其爆炸后的产物中 的氯元素化合价有大于+3价和小于+3价的化合物;
A、中氯元素化合价为-1和0价;不符合;
B、氯元素化合价-1和+1价;不符合;
C、氯元素化合价为+5和+7价,不符合;
D、氯元素化合价为-1和+5价,符合;
故答案为:D
(5)依据化合价变化:ClO-~Cl-~2e-;Fe(OH)3~FeO4n-~(5-n)e-;电子转移总数2(5-n),结合离子方程式的电子守恒、电荷守恒、原子守恒进行分析配平,写出离子方程式为:
2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(3+n)H2O
故答案为:2,(5-n),2n,2,(5-n),(n+3).
本题解析:
本题难度:简单