1、选择题 物质的量之比为2:5的锌与稀硝酸恰好反应,若硝酸被还原的产物为N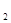 O,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是(?)
O,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是(?)
A.1:4
B.1:5
C.2:3
D.2:5
参考答案:A
本题解析:设锌的物质的量是2x,则稀硝酸的物质的量是5x。生成硝酸锌是2x。则根据原子守恒可知,被还原的硝酸是5x-2x×2=x,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是x:4x=1:4,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查学生灵活运用电子得失守恒进行有关氧化还原反应计算的能力,有利于培养学生的逻辑推理能力。
本题难度:一般
2、选择题 电视剧中所需的大量白烟是用NH4NO3和Zn粉按质量比16:13混合放于温热的石棉网上,使用时滴水数滴产生的。又知发生反应后有N2和水生成。有关的说法中正确的是①水起着溶解NH4NO3、发生吸热现象以及启动反应发生的作用;②1molNO3-在反应中得5mol e-;③成烟物质是氧化锌小颗粒;④NH4+是氧化剂
A.①②
B.②③
C.③④
D.①④
参考答案:B
本题解析:用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,换算物质的量之比=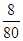 :
: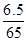 =1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B.
=1:1,使用时滴水数滴即产生大量的白烟.又知发生反应后有N2和水生成,结合元素化合价的升降守恒,可知氯化铵和锌按1:1恰好反应,无金属锌剩余,反应放出热量,化学方程式应为:B.NH4NO3+Zn=N2+2H2O+ZnO,成烟物质是氧化锌不是金属锌;①从反应过程分析,水起到了催化剂的作用使反应迅速放出大量的热,不是硝酸铵溶解吸热,故①错误;②根据发生的反应NH4NO3+Zn=N2+2H2O+ZnO,化合价升高的有:Zn~Zn2+~2e-,NH4+~N2~3e-,化合价降低的为:NO3-~N2~5e-,所以根据电子守恒可知,每还原1mol NO3-需氧化1molNH4+和1mol Zn;故②正确;③成烟物质是氧化锌,氧化锌是两性氧化物;故③正确;④成烟物质是两性氧化物氧化锌小颗粒;锌按照氧化还原反应电子守恒判断全部反应,所以成烟物质不是小锌粒,故④错误;综上所述:②③正确;故选B.
本题难度:一般
3、计算题 (16分)某1L溶液中含有大量的Cl—、Br—、I—,若向1L该溶液中通入一定量的氯气,溶液中Cl—、Br—、I—的物质的量与通入的氯气的体积(标准状况)的量关系如下表所示,分析后填写下列空白:
V(Cl2)(标况,L)
| 2.8
| 5.6
| 11.2
|
n(Cl—) /mol
| 1.5
| 1.75
| 2.25
|
n(Br—) /mol
| 1.5
| 1.4
| 0.9
|
n(I—)/mol
| a
| 0
| 0
|
⑴当通入氯气的体积为2.8L时,溶液中发生的离子反应式只有:?
⑵表中a的值为?
⑶原溶液中Cl—、Br—、I—物质的量之比为?
⑷原溶液中I—的物质的量浓度为?
参考答案:(16分)
⑴Cl2+2I―=2Cl―+I2⑵0.15⑶1.25∶1.5∶0.4或25∶30∶8(其余答案均不给分)⑷0.4mol/L
本题解析:明确:由于I—的还原性强于Br—,所以只有当I—先进行氧化反应,然后才是Br—被氧化;Cl2+2I―=2Cl―+I2? Cl2+2Br―=2Cl―+Br2
(1)当通入氯气的体积为2.8L时,溶液中还剩余I—,所以只有I—被氧化;
(2)当第二次通入氯气2.8L(0.125mol)时,I—已完全被氧化,Br—也被氧化了0.1 mol
Cl2?+? 2Br―?=2Cl―+Br2
0.05mol? 0.1mol
则与I—反应的氯气为0.125mol-0.05mol=0.075mol
Cl2?+? 2I―=2Cl―+I2
0.075mol? 0.15mol
所以表中a的值为0.15mol
(3)第一次通入氯气2.8L时,I—还有剩余,故只发生了:
Cl2?+? 2I―?=? 2Cl―?+? I2
0.125mol? 0.25mol? 0.25mol
则原溶液中:
含有I— 0.25mol + 0.15mol=0.4mol,而Br—为:1.5mol,Cl―为:1.5mol—0.25mol=1.25mol
⑷原溶液中I—的物质的量浓度为0.4mol/1L=0.4mol/L
本题难度:一般
4、填空题 I.已知有如下氧化还原反应:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O,则:
(1)该反应的还原剂为 ,还原产物为 。(写化学式)
(2)若产生的N2在标准状况下体积为2.24L,则反应中转移的电子数为 NA。
II.(6分)化学与我们的生活密切相关,请用化学方程式描述以下生活中的实例:
(1)盛有NaHCO3的干粉灭火器用于灭火?
(2)铁质菜刀的“淬火”工艺:将红热的菜刀浸入水中急速冷却?
(3)饲养金鱼用的自来水必须经过太阳暴晒后才能使用??
参考答案:I.(6分)(1)Zn和NH4NO3(2分); N2(2分) (2)0.5(2分)
II.(6分) (1)2NaHCO3 ?Na2CO3+CO2↑+H2O?
?Na2CO3+CO2↑+H2O?
(2)3Fe+4H2O  Fe3O4+4H2? (3)2HClO
Fe3O4+4H2? (3)2HClO 2HCl+O2↑?(每空2分)
2HCl+O2↑?(每空2分)
本题解析:I. (1)Zn、NH4NO3(NH4+中的N元素)化合价升高,是反应的还原剂。N2既是氧化产物又是还原产物。
(2)2.24L即0.1mol,反应中转移的电子数为0.5NA。
II. (1)利用NaHCO3加热易分解且生成CO2的原理,方程式为2NaHCO3 ?Na2CO3+CO2↑+H2O。
?Na2CO3+CO2↑+H2O。
(2)利用Fe在高温条件下与水蒸气反应的原理,方程式为3Fe+4H2O  Fe3O4+4H2。
Fe3O4+4H2。
(3)用氯气消过毒的水中含有HClO,且HClO具有强氧化性但见光易分解,需晒后才能使用,方程式为2HClO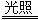 2HCl+O2↑。
2HCl+O2↑。
点评:本题考查氧化还原反应的应用和化学与生活的相关知识,要求学生具有分析和解决问题的能力,难度中等。
本题难度:一般
5、填空题 (16分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在接触室中发生的反应的化学方程式_____________________________
(4)碳和浓硫酸反应的化学方程式__________________________________
参考答案:
(1) Ca(ClO)2 + 2CO2 + 2H2O = 2HClO? +? Ca(HCO3)2
(2)3Cl2 + 2Fe2+? +? 4Br-? =? 6Cl- + 2Fe3+? +? 2Br2
(3)4FeS2 +11O2 ?2Fe2O3 + 8SO2
?2Fe2O3 + 8SO2
(4)SO2 + Br2 + 2H2O? =? 2HBr? + H2SO4
本题解析:
(1)这里是碳酸酸性强于次氯酸,先Ca(ClO)2 + CO2 + H2O =" 2HClO" + CaCO3↓,后是过量的二氧化碳:CO2 + H2O + CaCO3 = Ca(HCO3)2,两式叠加去掉碳酸钙即可。
(2)氯气能氧化二价铁和溴离子,先写出方程式:3Cl2+2FeBr2=2FeCl3+2Br2,然后改成离子方程式。
(3)制硫酸用的是黄铁矿即FeS2先锻烧后生成二氧化硫,再进一步氧化成三氧化硫,再用浓硫酸吸收生成的三氧化硫,在接触中则发生4FeS2+11O2=(高温)2Fe2O3+8SO2,配平时要注意其有两种元素变价。
(4)溴是卤族元素,很容易想到具有强氧化性,被还原成Br-,根据氧化还原反应的特点,二氧硫当体现还原性,在溶液中往往以SO42-的形式存在,先写出Br2+SO2→2Br-+ SO42-,剩余的部分通过原子守恒补足。
本题难度:一般