1、简答题 【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B元素原子的核外p电子数比s电子数少1
C原子的第一至第四电离能分别是:
I1=738kJ/molI2=1451kJ/molI3=7733kJ/molI4=10540kJ/mol
D原子核外所有p轨道全满或半满
E元素的主族序数与周期数的差为4
F是前四周期中电负性最小的元素
G在周期表的第七列
|
(1)G位于______族______区,价电子排布式为______.
(2)B基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈______
形.
(3)画出C原子的电子排布图______.
(4)已知BA5为离子化合物,写出其电子式______.
(5)DE3中心原子的杂化方式为______,用价层电子对互斥理论推测其空间构型为______.
(6)用电子式表示F元素与E元素形成化合物的形成过程______.
参考答案:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,为H元素;
B元素原子的核外p电子数比s电子数少1,且B是短周期元素,如果B是第三周期元素,则不可能出现p电子比s电子少1,则B为第二周期元素,为N元素;
C的原子序数大于B且为短周期元素,根据C的电离能知,C属于第ⅢA族元素,为Al元素;
D原子核外所有p轨道全满或半满且为短周期主族元素,原子序数大于C,则D是P元素;
E元素的主族序数与周期数的差为4,且E为短周期主族元素,E的原子序数大于D,则E是Cl元素;
F是前四周期中电负性最小的元素,即为最活泼的金属元素,为K元素;
G在周期表的第七列,且为第四周期元素为Mn元素,
(1)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2,
故答案为:ⅦB;d;3d54s2;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤或哑铃形,
故答案为:3;纺锤或哑铃形;
(3)C是Al元素,根据构造原理知,其原子核外电子排布图为: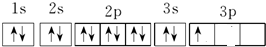 ,
,
故答案为: ;
;
(4)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为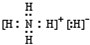 ,
,
故答案为: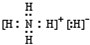 ;
;
(5)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥,
故答案为:sp3;三角锥;
(6)钾原子和氯原子通过得失电子形成离子键,用电子式表示其形成过程为: ,
,
故答案为: .
.
本题解析:
本题难度:一般
2、选择题 下列不是元素的电负性应用的是
[? ]
A.判断一种元素是金属还是非金属
B.判断化合物中元素化合价正负
C.判断化学键类型
D.判断化合物溶解性
参考答案:D
本题解析:
本题难度:简单
3、简答题 2010年上海世博会场馆大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
(1)镓的基态原子的电子排布式是______.
(2)比较二者的第一电离能:As______Ga(填“<”、“>”或“=”).
(3)砷化镓晶胞中所包含的砷原子(白色球)个数为______,与同一个镓原子相连的砷原子构成的空间构型为______.
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得.(CH3)3Ga中镓原子的杂化方式为______.
(5)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是______.(用氢化物分子式表示)
(6)下列说法正确的是______(填字母).
A.砷化镓晶胞结构与NaCl相同?B.GaP与GaAs互为等电子体
C.电负性:As>Ga?D.砷化镓晶体中含有配位键.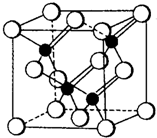
参考答案:(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63d104s24p1或[Ar]3d104s24p1,
故答案为:1s22s22p63d104s24p1;
(2)As和Ga处于同一周期,而处于VA的As外围电子处于半满的较稳定结构,故As的第一电离能大于Ga,
故答案为:>;
(3)根据“均摊法”:白色球个数为6×12+8×18)=4.由晶胞图可知与同一个镓原子相连的砷原子构成的空间构型为正四面体,故答案为:4;正四面体;
(4)由于Ga原子周围只有3对成键电子对,故其杂化方法为sp2,故答案为:sp2;
(5)由于NH3分子间存在氢键,所以NH3的沸点最高,由于AsH3的相对分子质量大于PH3,故AsH3的沸点高于PH3,
故答案为:NH3>AsH3>PH3;
(6)A.NaCl晶体中阴阳离子的配位数为6,而砷化镓晶胞中中阴阳离子的配位数为8,二者晶体结构不同,故A错误;
B.根据等电子体的概念可知二者价电子数相等,属于等电子体,故B正确;
C.周期表同周期元素从左到右元素的电负性逐渐增大,则As>Ga,故C正确;
D.由于Ga原子最外层只有3个电子,而每个Ga原子与4个As原子成键,因此其中一个共价键必为配位键,故D正确.
故答案为:BCD.
本题解析:
本题难度:一般
4、填空题 比较下列多电子原子的原子轨道的能量高低.
(1)2s______3s (2)2s______3d(3)3d______4s(4)4f______6f(5)3px______3pz.
参考答案:(1)不同电子层上形状相同的原子轨道能量的高低顺序:1s<2s<3s<4s…;所以2s<3s;
(2)不同层不同能级,原子轨道能量的高低顺序:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f…,所以2s<3d
(3)不同层不同能级,原子轨道能量的高低顺序:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f…,所以3d>4s;
(4)不同电子层上形状相同的原子轨道能量的高低顺序:1s<2s<3s<4s…,所以4f<6f;
(5)能层、能级均相同的原子轨道能量相等,所以3px=3pz;
故答案为:(1)<;(2)<;(3)>;(5)<;(6)=.
本题解析:
本题难度:一般
5、选择题 一定量的甲烷燃料后得到的产物CO、CO2和水蒸气,其总质量为49.6 g,当其缓慢经过无水CaCl2时,CaCl2增重25.2 g,原混合气体中CO2的质量是
A.12.5 g
B.13.2 g
C.19.7 g
D.24.4 g
参考答案:B
本题解析:
本题难度:困难