1、填空题 (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(25℃、101 kPa下测得的热量)。
①反应的热化学方程式为__________________________。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是
__________________________。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。则N-H键的键能是_____________。
2、填空题 “富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
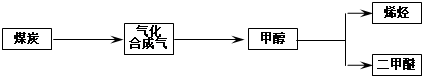
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol
3、选择题 下列热化学方程式书写正确的是( ? )
A.2SO2+O2?2SO3;△H=-196.6kJ/mol
B.C(s)+O2(g)═CO2(g);△H=393.5kJ/mol
C.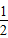 H2(g)+
H2(g)+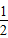 Cl2(g)═HCl(g);△H=-92.5kJ/mol
Cl2(g)═HCl(g);△H=-92.5kJ/mol
D.H+(aq)+OH-(aq)═H2O(l);△H=57.3kJ
4、填空题 (14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
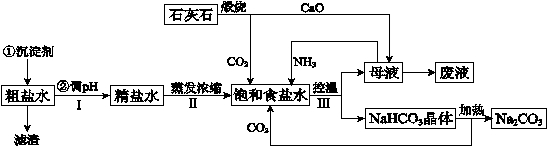
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下:

Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是 。
5、填空题 (10分)试回答下列各问题:
(1)如图Ⅰ所示是1 mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
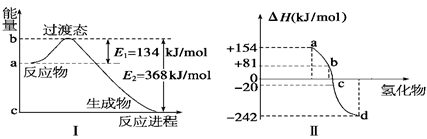
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g) ="==" 2HCl(g) ΔH="-185" kJ/mol;
键能ΔH298(H—H)="436" kJ/mol,ΔH298(Cl—Cl)="247" kJ/mol,则ΔH298(H—Cl)= 。
②图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氢化物时的焓变数据,根据这组焓变数据可确定a、b、c、d分别代表的元素,试写出硒化氢发生分解反应的热化学方程式: 。
(3)已知: ①Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH="-a" kJ/mol
2Fe(s)+3CO2(g) ΔH="-a" kJ/mol
②3Fe2O3(s)+CO(g)  2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol
2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol
③Fe3O4(s)+CO(g)  3FeO(s)+CO2(g) ΔH="+ckJ/mol"
3FeO(s)+CO2(g) ΔH="+ckJ/mol"
则FeO(s) +CO(g)  Fe(s)+CO2(g) ΔH=- 。
Fe(s)+CO2(g) ΔH=- 。