1、填空题 (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(25℃、101 kPa下测得的热量)。
①反应的热化学方程式为__________________________。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是
__________________________。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。则N-H键的键能是_____________。
参考答案:(1)N2H4(l)+2H2O2(l)==N2(g)+4H2O(g) △H=-641.75KJ/mol;408.875KJ;产物不会造成环境污染
(2)391.6 kJ·mol-1
本题解析:
本题难度:一般
2、填空题 “富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
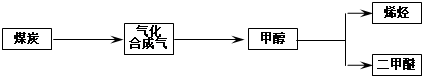
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol
参考答案:
本题解析:
本题难度:困难
3、选择题 下列热化学方程式书写正确的是( ? )
A.2SO2+O2?2SO3;△H=-196.6kJ/mol
B.C(s)+O2(g)═CO2(g);△H=393.5kJ/mol
C.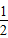 H2(g)+
H2(g)+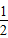 Cl2(g)═HCl(g);△H=-92.5kJ/mol
Cl2(g)═HCl(g);△H=-92.5kJ/mol
D.H+(aq)+OH-(aq)═H2O(l);△H=57.3kJ
参考答案:C
本题解析:
本题难度:一般
4、填空题 (14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
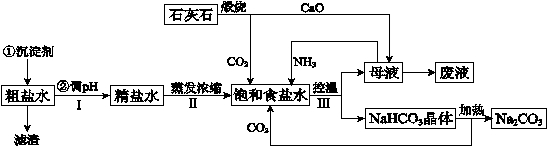
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下:

Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是 。
参考答案:(14分,每空2分)
(1)CaCO3、Mg(OH)2(漏写得1分,错答得0分)
(2)2NH4Cl+CaO=CaCl2+2NH3↑+2H2O
(3)NH3 ; NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl
(4)Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH=" +" 58.73 kJ·mol-1
(5)106(b-a)/11a
(6)CH4-8e-+4CO32-=5CO2+2H2O
本题解析:(1)粗盐中的钙、镁离子可与石灰乳和纯碱反应生成碳酸钙和氢氧化镁沉淀,所以滤渣的成分除过量的沉淀剂外还有CaCO3、Mg(OH)2;
(2)CaO投入水中生成氢氧化钙,与氯化铵反应产生氨气、氯化钙、水,所以该反应的化学方程式是2NH4Cl+CaO=CaCl2+2NH3↑+2H2O;
(3)因为二氧化碳在水中的溶解度不大,所以先通入氨气,增大溶液的碱性,再通入二氧化碳气体;氨气、二氧化碳与饱和食盐水反应生成氯化铵和碳酸氢钠沉淀,化学方程式是NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl;
(4)根据碳酸钠晶体失水的能量变化示意图可知,Na2CO3·10H2O(s)= Na2CO3(s) +10H2O(g) ΔH=+532.36kJ/mol,Na2CO3·10H2O(s)= Na2CO3·H2O (s) +9H2O(g) ΔH=+473.63kJ/mol,根据盖斯定律,两式相减Na2CO3·H2O (s) 脱水反应的热化学方程式是Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH=+532.36kJ/mol-(+473.63kJ/mol)="+" 58.73 kJ·mol-1;
(5)碳酸钠与盐酸反应生成硫酸钠、水和二氧化碳,加热蒸干后得到的固体为氯化钠,发生反应的化学方程式是,Na2CO3+2HCl=2NaCl+CO2↑+H2O,利用差量法,设样品中碳酸钠的质量是x,则
Na2CO3+2HCl=2NaCl+ CO2↑+ H2O 固体质量差
106 117 117-106=11
x (b-a)g
所以106:11=x:(b-a)g,解得x=106(b-a)/11g,则该产品中Na2CO3的质量分数是106(b-a)/11g/ag=106(b-a)/11a;
(6)用熔融碳酸钠作电解质,甲烷燃料电池中,负极发生氧化反应,则甲烷在负极发生氧化反应,失去电子,生成二氧化碳和水,所以负极的电极反应式是CH4-8e-+4CO32-=5CO2+2H2O。
考点:考查联合制碱法的工艺流程,盖斯定律的应用,电化学反应原理的应用
本题难度:困难
5、填空题 (10分)试回答下列各问题:
(1)如图Ⅰ所示是1 mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
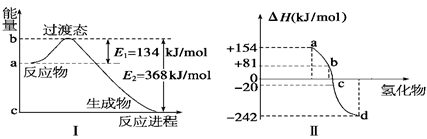
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g) ="==" 2HCl(g) ΔH="-185" kJ/mol;
键能ΔH298(H—H)="436" kJ/mol,ΔH298(Cl—Cl)="247" kJ/mol,则ΔH298(H—Cl)= 。
②图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氢化物时的焓变数据,根据这组焓变数据可确定a、b、c、d分别代表的元素,试写出硒化氢发生分解反应的热化学方程式: 。
(3)已知: ①Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH="-a" kJ/mol
2Fe(s)+3CO2(g) ΔH="-a" kJ/mol
②3Fe2O3(s)+CO(g)  2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol
2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol
③Fe3O4(s)+CO(g)  3FeO(s)+CO2(g) ΔH="+ckJ/mol"
3FeO(s)+CO2(g) ΔH="+ckJ/mol"
则FeO(s) +CO(g)  Fe(s)+CO2(g) ΔH=- 。
Fe(s)+CO2(g) ΔH=- 。
参考答案:(1)NO2(g)+CO(g) ="==" NO(g)+CO2(g) ΔH="-234" kJ/mol
(2)①434 kJ/mol。②H2Se(g) ="==" Se(s)+H2(g) ΔH="-81" kJ/mol
(3)ΔH= -1/6(3a-b+2c)kJ/mol
本题解析:(1)根据图Ⅰ可知反应物的总能量高于生成物的总能量,是放热反应,放出的热量是368kJ/-134 kJ=234 kJ,所以热化学方程式为NO2(g)+CO(g) ="==" NO(g)+CO2(g) ΔH="-234" kJ/mol。
(2)②反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此ΔH="=436" kJ/mol+247 kJ/mo-2X=-185 kJ/mo,解得X=434 kJ/mol。
①非金属性越强,和氢气化合越剧烈,放出的热量就越多。所以a、b、c、d分别代表的元素是碲、硒(Se) 、硫、氧。生成硒化氢的反应是吸热反应,则逆反应就是放热反应,所以硒化氢发生分解反应的热化学方程H2Se(g) ="==" Se(s)+H2(g) ΔH="-81" kJ/mol。
(3)根据盖斯定律可知,①×3-②-③×2即得到6FeO(s) +6CO(g)  6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。
6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。
本题难度:一般