1、填空题 已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
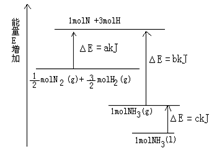
(1)1mol N 和3mol H 生成1mol NH3(g)是 能量的过程(填“吸收”或“释放”)。
(2)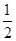 N2(g)+
N2(g)+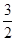 H2(g)
H2(g)  NH3(g ) △H= ;
NH3(g ) △H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
参考答案:(1)释放 (2)-( b - a) kJ·mol-1
(3)N2(g)+3H2(g)=2NH3 △H="-2(b+c" -a)kJ·mol-1
本题解析:(1)根据图像可知,1mol N 和3mol H 生成1mol NH3(g)是释放能量的。
(2)根据图像可知,反应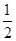 N2(g)+
N2(g)+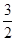 H2(g)
H2(g)  NH3(g )的△H=-( b-a) kJ/mol。
NH3(g )的△H=-( b-a) kJ/mol。
(3)根据图像可知,N2(g)和H2生成NH3(1)的热化学方程式为N2(g)+3H2(g)=2NH3 △H=-2(b+c -a)kJ·mol。
考点:考查反应热的判断、计算以及热化学方程式的书写
点评:该题是基础性试题饿考查,难度不大。该题的关键是明确反应热的计算依据,然后结合图像灵活运用即可。
本题难度:一般
2、填空题 (8分) Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的价电子排布式为3d64s2。
(1)Z位于元素周期表第________周期第________族,
(2)W的第一电离能________(填“大于”或“小于”)X的第一电离能。
(3)Z基态原子的价电子排布图为______________________________________,Z的单质与过量的X 的最高价氧化物对应的水化物的稀溶液反应的离子方程式为____________________。
(4)已知:①WQ4(g)+4XY2(g)=4XY(g)+WY2(g)+2Q2Y(g) ΔH=-574 kJ/mol
②WQ4(g)+4XY(g)=2X2(g)+WY2(g)+2Q2Y(g) ΔH=-1 160 kJ/mol
此温度下若用4.48 L(已折算成标准状况下)WQ4还原XY2至X2。整个过程中放出的热量为___kJ。
参考答案:(1)四;Ⅷ (2)小于 (3)
Fe+4H++NO3-=Fe3++NO↑+2H2O (4)173.4
本题解析:Q、W、X、Y、Z元素为前四周期元素,且原子序数依次增大,Q元素的阳离子核外无电子,则Q是氢元素。W元素原子的最外层电子数是次外层电子数的2倍,因此W的是碳元素。Y是地壳中含量最多的元素,则Y是氧元素,因此X是氮元素。Z的价电子排布式为3d64s2,则Z的原子序数是26,即为铁元素。
(1)铁位于元素周期表第四周期第Ⅷ族。
(2)非金属性越强第一电离能越大,则碳的第一电离能“小于氮的第一电离能。
(3)铁的原子序数是26,则根据核外电子排布规律可知基态原子的价电子排布图为
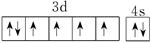 ;
;
硝酸具有强氧化性,与铁反应的的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O。
(4)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ/mol,②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ/mol,则根据盖斯定律可知(①+②)÷2即得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ/mol.4.48 L(已折算成标准状况下)CH4的物质的量是0.2mol,则还原NO2至N2的整个过程中放出的热量为867kJ/mol×0.2mol=173.4kJ。
考点:考查元素推断的有关应用
本题难度:困难
3、选择题 有关键能(破坏1 mol共价键吸收的能量)数据如表
化学键
| Si—O
| O===O
| Si—Si
|
键能/kJ·mol-1
| X
| 498.8
| 176
|
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键)
A.423.3 B.460 C.832 D.920
参考答案:B
本题解析:根据反应热=反应物的键能总和-生成物的键能总和分析,2×176+498.8-4x=-989.2,解x=460,选B。
考点: 反应热的计算
本题难度:一般
4、简答题 2007年10月24日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥一号”探月卫星成功送入太空,迈出了向广寒宫求索的第一步.“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,第三级为液态氧燃料.
(1)常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体).
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ?mol-1
H2(g)+F2(g)=HF(g);△H=-269kJ?mol-1
H2(g)+O2(g)=H2O(g);△H=-242kJ?mol-1
请写出肼和氟气反应的热化学方程式:______;
(2)氢是一种理想的绿色能源,最近科学家利用太阳光分解水来制备氢.如图为光分解水制氢的循环系统,反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用.
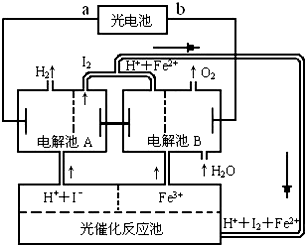
①判断光电池的a端为______极,b端为______极;
②写出电解池A中电极反应式:
阴极______,阳极______;
③电解池B中反应的离子方程式______;
④若电解池A中生成H2的体积为8.96L(标准状况下),则电解池B中生成Fe2+的物质的量为______.
参考答案:(1)由N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ?mol-1①
12H2(g)+12F2(g)=HF(g);△H=-269kJ?mol-1②
H2(g)+12O2(g)=H2O(g);△H=-242kJ?mol-1③
利用盖斯定律可知①+②×4-③×2可得反应N2H4(g)+2F2(g)=N2(g)+4HF(g),
该反应的△H=(-543kJ?mol-1)+4×(-269kJ?mol-1)-2×(-242kJ?mol-1)=-1135kJ?mol-1,
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ?mol-1
(2)电解池左边放出氢气,氢离子在此得到电子,故左侧为电解池阳极,所以a端为原电池负极,b端为正极碘离子在此失去电子.
故答案为:①负,正
②2H++2e-→H2↑,2I-→I2+2e-
③4Fe3++2H2O
O2↑+4H++4Fe2+?
(4)据原电池原理,得失电子守恒有n(H2)=V/Vm=8.96L/22.4molL-1=0.4mol,所以 故答案为:失去电子数为2×0.4mol=0.8mol,Fe3+→Fe2+,得到电子数为2×0.4mol
故答案为:0.8mol
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3
B.已知难溶物FeS的Ksp=8.1×10-17,FeS饱和溶液中c(H+)2?c(S2-)=1.0×10-22,为使溶液里c(Fe2+)达到了1mol?L-1,应调节溶液中的c(H+)为1.11×10-3mol?L-1
C.稀氨水中部分粒子的浓度大小关系:c(NH4+)>c(OH-)>c(H+)>c(NH3?H2O)
D.已知氢气的标准燃烧热为285.8kJ?mol-1,相应的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-285.8kJ?mol-1
参考答案:B
本题解析:
本题难度:一般