1、选择题 已知乙烯能使酸性高锰酸钾溶液褪色,下列褪色原理与其一致的是( )
A.SO2使品红溶液褪色
B.乙烯使溴水褪色
C.SO2使溴水褪色
D.甲烷使氯气褪色
参考答案:C
本题解析:乙烯能使酸性高锰酸钾溶液褪色是被氧化,发生的是氧化还原反应。A.SO2使品红溶液褪色发生的是结合漂白,错误;B.乙烯使溴水褪色发生的是加成反应,错误;C.SO2使溴水褪色发生的是氧化还原反应,正确;D.甲烷使氯气褪色发生的是取代反应,错误。
本题难度:一般
2、选择题 下列物质的性质属于物理性质的是……( )
A.二氧化硫的漂白性
B.浓硫酸的脱水性
C.浓硝酸的不稳定
D.浓盐酸的挥发性
参考答案:D
本题解析:上述物质在体现出漂白性、脱水性和不稳定性时 ,分别能使二氧化硫、被浓硫酸脱水的物质和浓硝酸生成新物质。浓盐酸在挥发出溶质氯化氢时,我们可以把它看作挥发前后仅是状态的不同,所以划归
物理变化,应选D
本题难度:简单
3、实验题 (18分)含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
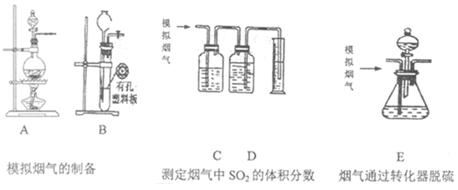
回答下列问题:
I.模拟烟气的制备
(1)用A装置制SO2,其化学反应方程式为?。
(2)用B装置制CO2,使用该装置优点的是?。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是?、?。(填序号)
①KMnO4溶液? ②饱和NaHSO3溶液? ③饱和Na2CO3溶液? ④饱和NaHCO3溶液
(5)若模拟烟气的流速为a mL/min,若t1分钟后,测得量简内液体体积为V mL(已折算为标准状况),则SO2的体积分数是?。
III.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出SO2与FeCl3溶液参与反应过程的离子方程式?。
(7)若模拟烟气仍以a mL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经?、洗涤、?、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是?。
参考答案:I.(1)Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑(2分)
CuSO4 + 2H2O + SO2↑(2分)
(2)可以随时控制反应的发生和停止(2分)
Ⅱ.(4)①? ④(各1分,共2分) (5)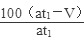 % (3分)
% (3分)
(6)2H2O + 2Fe3+ + SO2 =2Fe2+ + SO42- + 4H+?(2分)
(7)过滤 (2分)?干燥 (2分)?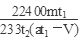 (3分)
(3分)
本题解析:(1)装置A需要加热,这说明所用试剂是浓硫酸和铜,反应的化学方程式为Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑。
CuSO4 + 2H2O + SO2↑。
(2)B装置制CO2,属于简易启普发生器,使用该装置优点的是通过控制长颈漏斗盐酸的加入量,控制反应的发生和停止。
Ⅱ.(4)二氧化硫具有强的还原性,可以用强氧化性的高锰酸钾吸收;二氧化碳在饱和碳酸钠溶液中的溶解度很小,可以用排饱和碳酸氢钠溶液来侧量其体积,故答案为:①④;
(5)二氧化碳的体积是Vml,则二氧化碳的体积分数为: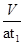 ?,则二氧化硫的体积分数为100%-
?,则二氧化硫的体积分数为100%-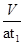 =
=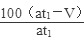 %;
%;
(6)①SO2+2H2O+2Fe3+═SO42-+2Fe2++4H+在反应①中三价铁离子被还原为二价铁离子,要想保持质量、性质不变,得到的二价铁离子应该被氧气氧化为三价铁离子,反应的方程式为:4Fe2++O2+4H+=2H2O+4Fe3+;
(7)为了保证准确的测量出反应生成的硫酸钡固体,从溶液中分离固体硫酸钡,依次进行过滤、洗涤、干燥的操作;t2分钟内烟气中含二氧化硫的体积为:V(SO2)=at2×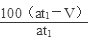 %;根据上述反应可知各物质之间量的关系为:
%;根据上述反应可知各物质之间量的关系为:
SO2~SO42-~BaSO4
22400ml?233g
V(SO2)′? mg
所以转化的二氧化硫气体的体积为:V(SO2)′=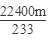
则二氧化硫的转化率=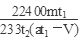
本题难度:一般
4、选择题 下列有关实验现象和解释或结论都正确的是
选项
| 实验操作
| 实验现象
| 解释或结论
|
A
| 将充满NO2的密闭玻璃球浸泡在热水中
| ?红棕色变深
| ?反应2NO2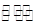 N2O4的 N2O4的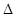 H<0 H<0
|
B
| 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡
| 下层分别呈无色?和紫红色
| ?还原性:I->Br->Fe2+
|
C
| 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水
| 有白色沉淀出现
| ?该钾盐是K2CO3
|
D
| ?把SO2通入紫色石蕊试液中
| ?紫色褪去
| ? SO2具有漂白性
参考答案:A
本题解析:A、将充满NO2的密闭玻璃球浸泡在热水中,红棕色变深,说明升高温度反应2NO2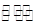 N2O4平衡逆向移动,△H<0,正确;B、将少量的溴水分别滴入FeCl2溶液、NaI溶液中,发生的反应分别为Br2 + 2Fe2+====2Fe3+ + 2Br-、Cl2 + 2I- ====2Cl- + I2,还原性:Fe2+>Br-、I->Cl-,错误;C、某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水有白色沉淀出现,该钾盐是K2CO3、KHCO3或二者的混合物,错误;D、把SO2通入紫色石蕊试液中,二氧化硫溶于水显酸性,溶液变红,错误。 N2O4平衡逆向移动,△H<0,正确;B、将少量的溴水分别滴入FeCl2溶液、NaI溶液中,发生的反应分别为Br2 + 2Fe2+====2Fe3+ + 2Br-、Cl2 + 2I- ====2Cl- + I2,还原性:Fe2+>Br-、I->Cl-,错误;C、某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水有白色沉淀出现,该钾盐是K2CO3、KHCO3或二者的混合物,错误;D、把SO2通入紫色石蕊试液中,二氧化硫溶于水显酸性,溶液变红,错误。
本题难度:一般
5、填空题 (15分)以黄铁矿为原料生产硫酸的工艺流程图如下:
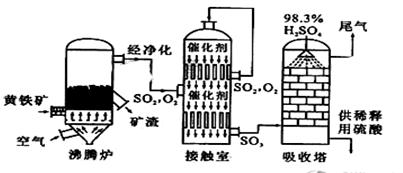
(1)写出燃烧黄铁矿的化学方程式?。
当有6mol SO2生成时,转移电子?mol。
(2)进入接触室的气体中含标准状态下1120m3SO2气体,达平衡后放出热量为4.728×106kJ,此时SO2转化率为96%。该反应的热化学方程式为?。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)?。
a.为使黄铁矿充分燃烧,需将其粉碎?
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁?
e.吸收塔用水作吸收剂
(4)某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是多少?(假设杂质不参加反应)
(5)该生产过程中产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的是?。(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞
参考答案:(1)4FeS2?+ 11O2 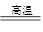 ?2Fe2O3+8SO2?(2分)?33(2分) ?2Fe2O3+8SO2?(2分)?33(2分)
(2)2SO2(g) + O2(g) = 2SO3(g) ;⊿H=-197 kJ/mol (2分)
(3)a? b? d (各1分)
(4)? 3FeS2?~? 2Cr2O72-
3×120? 2
m(FeS2)?0.0200×25.00×10-3
m(FeS2)= 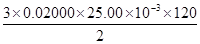 =0.09000g =0.09000g
w(FeS2)= 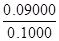 ×100%=90.0%?(4分)?(5)BC (2分) ×100%=90.0%?(4分)?(5)BC (2分)
本题解析:(1)黄铁矿燃烧生成SO2和氧化铁,方程式为4FeS2?+ 11O2 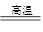 ?2Fe2O3+8SO2 。反应中氧气是氧化剂,转移电子是44,所以当有6mol SO2生成时,转移电子44mol÷8×6=33mol。 ?2Fe2O3+8SO2 。反应中氧气是氧化剂,转移电子是44,所以当有6mol SO2生成时,转移电子44mol÷8×6=33mol。
(2)标准状态下1120m3SO2气体是50000mol,所以反应中消耗的SO2是50000mol×0.96=48000mol,所以2molSO2反应放出的热量是4.728×106kJ÷24000=197 kJ/mol,所以热化学方程式为2SO2(g) + O2(g) = 2SO3(g) ;⊿H=-197 kJ/mol。
(3)粉碎可以增大反应物的接触面积,加快反应速率,a正确。增大氧气的浓度可以提高SO2的转化率,b正确。催化剂不能改变平衡状态,只能改变反应速率,c不正确。d正确,阿保质期,用浓硫酸吸收,答案选abd。
(4)考查根据关系式进行的有关计算。根据有关方程式可知
3FeS2?~? 2Cr2O72-
3×120? 2
m(FeS2)? 0.0200×25.00×10-3
m(FeS2)= 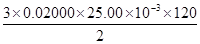 =0.09000g =0.09000g
w(FeS2)= 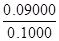 ×100%=90.0% ×100%=90.0%
(5)SO2具有还原性,所以BC正确,AD不正确,因为三氧化硫和酸雾也能被吸收。答案选BC。
本题难度:一般
|