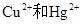1、填空题 (10分)(1)我国酸雨危害十分严重,是世界三大酸雨区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中?含量超标。形成硫酸型酸雨发生的主要反应的化学方程式为
途径一:?;
途径二:?。
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
时间
| 开始
| 8 h后
| 16 h 后
| 24 h后
| 32 h后
| 4O h后
| 48 h后
|
pH
| 5.O
| 4.8
| 4.5
| 4.3
| 4.2
| 4.O
| 4.O
|
?请根据上述材料,回答下列有关问题:
①酸雨放置时,pH发生变化的主要原因为?
(3)你认为减少酸雨产生的途径可采取的措施是??
A、用煤作燃料? B、把工厂烟囱造高? C、燃料脱硫? D、开发新能源
2、选择题 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(不挥发性)
3、实验题 (每空2分,共6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。请回答下列问题:

(1)若向A中通入足量的二氧化硫气体,A中的现象是?。
(2)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和?性。
(3)如果A中盛的是浓盐酸,加入二氧化锰,加热反应,此反应中浓盐酸的作用是?。
4、计算题 (8分)某研究性学习小组用48.0克铜屑与氧化铜的混合物与硫酸和硝酸的混酸100 ml溶液反应制取五水硫酸铜晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后溶液中只有硫酸铜。若在固体混合物中铜屑的质量分数为0.4,试计算:(1)最终制得晶体的质量。(2)混酸中两溶质的物质的量浓度。
5、选择题 下列措施不合理的是
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S作沉淀剂,除去废水中的