1、选择题 一定量的盐酸跟少量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入
A.KNO3溶液
B.NaCl溶液
C.铜粉
D.硫酸铜晶体
参考答案:B
本题解析:考查外界条件对反应速率的影响。加入KNO3溶液后,在酸性溶液中NO3-和铁反应生成的气体不会是氢气,A不正确。 NaCl溶液不参与反应,但溶液体积增大,会降低盐酸的浓度,反应速率降低,正确。加入铜粉,可构成原电池加快反应速率,不正确。加入硫酸铜晶体后,铁可置换出铜,构成原电池,加快反应,不正确。答案是B。
本题难度:简单
2、实验题 (12分)某校的探究小组同学想研究氧化铜能否在氯酸钾的受热分解反应中起催化剂的作用,设计了以下的对比实验和操作步骤:
①任取两份氯酸钾,分别放入两支试管,在其中一份中加入经精确称量的n g氧化铜粉末。
②将两份氯酸钾同时在相同的条件下加热,将放出的气体通入水中,观察放出气体的快慢。
③停止加热、冷却,将原先混有氧化铜的反应后的混合物加水溶解,小心过滤,将滤出固体物质洗涤并干燥。
④观察滤出固体物质的状态、颜色。
⑤将滤出固体物质和炭粉混合,在密闭容器中加热,并将反应产生的气体通入澄清石灰水中,并观察实验现象。
(1)从以上有关实验步骤的叙述中可发现操作方案还存在一些缺陷,请指出并加以改进:
______________________________________________________________________、
______________________________________________________________________。
(2)有人换用另一种方法来代替上述第⑤操作,请从下图中选择仪器中连接成一套实验装置,这套实验装置的连接顺序是______ _接______、________接______、________接________接_______(气流的方向从左往右)。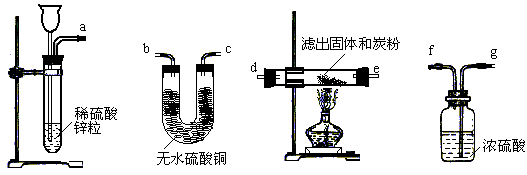
参考答案:(1)第①、④两步不严密;第①步中“任取两份氯酸钾”应改为“准确称量两份等质量的氯酸钾”,第④步中应改为“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量”。
(2)a接g、f接d、e(或d)接b(或e)接g。
本题解析:(1)要证明氧化铜是催化剂,须证明反应前后氧化铜的质量没有变化、氧化铜的化学性质没有改变,所以这是一个定量实验,不能任取两份氯酸钾。即①不正确,应该是“准确称量两份等质量的氯酸钾”。第④中观察状态和颜色只是定性,还需要定量,所以应该是“观察滤出固体物质的状态、颜色,并准确称量干燥后滤出物的质量”。
(2)分析题给实验装置图,可知是用H2还原氧化铜的方法来证明分离出来的固体仍是氧化铜,进而证明氧化铜是催化剂。a中产生H2通入g,目的是用浓硫酸来干燥H2;再经f接d、e(或d),目的是使H2跟氧化铜反应生成铜和水;进而接b(或e),使产生水蒸气跟无水硫酸铜反应生成蓝色硫酸铜晶体,证明有硬质玻璃管中发生反应;未端再接g是为了防止空气中水蒸气进入U管。
本题难度:一般
3、填空题 对于在密闭容器中进行的反应2SO2+O2

2SO3,其他条件不变,只改变一个反应条件,将生成SO3的反应速率的变化填入由表中空格里.(选填增大、减小或不变)
| ? | 改变条件 | 速率变化
①
降低温度
?
②
增加O2浓度
?
③
使用V2O5做催化剂
?
④
压缩气体
?
参考答案:①温度对化学反应速率的影响是:温度越高,反应速率越大,温度越低,反应速率越小,故答案为:减小.
①浓度对化学反应速率的影响是:浓度越大,反应速率越大,浓度越小,反应速率越小,故答案为:增大.
③催化剂对化学反应速率的影响是:加入正催化剂,反应速率加快,V2O5是其正催化剂,所以反应速率加快,故答案为:增大.
③压强对化学反应速率的影响是:增大压强,反应速率加快,减小压强,反应速率减慢,压缩体积,增大体系压强,故答案为:增大.
本题解析:
本题难度:简单
4、选择题 下列体系加压后,对化学反应速率没有影响的是
A.2SO2+O2 2SO3 2SO3
B.CO+H2O(g)  CO2+H2 CO2+H2
C.CO2+H2O H2CO3 H2CO3
D.H++OH- H2O H2O
|
参考答案: D
本题解析: 压强对反应速率的影响,一般只能影响到气体,而选项D中没有气体参加或生成,所以改变压强不能影响该反应的反应速率,答案选D。
考点:考查外界条
件压强对反应速率的影响
本题难度:一般
5、填空题 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,

请回答下列问题:
(1)写出该反应的化学方程式: 。
(2)0-6 s内,B的平均反应速率为: 。
(3)下列说法正确的是( )
A.反应进行到1 s时,v(A)=v(D)
B.反应进行到6 s时,各物质的反应速率相等
C.反应进行到6 s时反应停止。
D.当反应达到平衡状态时4v(A)=5v(C)
参考答案:18.(1)3B+4C 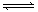 5A+2D (2)0.05 mol·L-1·s-1 (3)D
5A+2D (2)0.05 mol·L-1·s-1 (3)D
本题解析:(1)当反应进行到6s时达到平衡状态,根据曲线变化可知AD是反应物,BC是生成物,各物质平衡后都存在,该反应为可逆反应,再根据物质的量变化之比等于化学计量数之比,ABCD四种物质的物质的量变化为1、0.6、0.8、0.4,则该反应的化学方程式为:3B+4C 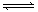 5A+2D;
5A+2D;
(2)0-6 s内,B的平均反应速率为0.6mol/(2L×6s)= 0.05 mol·L-1·s-1;
(3)A.化学反应速率之比等于化学计量数之比,v(A)不等于v(D),错误;B.反应进行到6 s时,各物质的反应速率不相等,错误;C.反应进行到6 s时达到平衡状态,但反应并未停止,错误;D.当反应达到平衡状态时4v(A)=5v(C),正确;选D。
考点:考查化学平衡图像,化学反应速率的计算等知识。
本题难度:一般