1、简答题 一定条件下,发生如下反应:A(g)+2B(g)?xC(g)+D(g)△H<0,x为正整数).
(1)450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB,测得容器内c(A)

随时间变化如图所示.
①x的值为______;(以下各题均用此数据)平衡常数表达式K=______.
②甲容器内从起始到平衡时,反应速率v(B)______mol/(L?s).
③若向甲容器中再充入2molA、4molB,则达平衡时,A的物质的量浓度的范围:______<c(A)<______.
(2)对(1)反应中达到平衡后的乙容器,升温至600℃时,此时K值应______(填“增大”或“减小”或“不变”).
(3)根据

题意,下列曲线符合变化规律的是______.
(4)450℃时甲容器中,判断该反应达到化学平衡状态的依据是______.
A.容器中压强不变?B.v?(B)(正)=2v(C)(逆)
C.容器中密度不变?D.c?(A)=c(D)
参考答案:(1)①450℃时,向甲、乙两容积均为1L的恒容容器中,分别充入2molA、4molB和1molA、2molB,由图可知,起始c(A)=2mol/L时,转化率为2-0.782×100%=61%,起始c(A)=1mol/L时,转化率为1-0.51×100%=50,则压强越大,A的转化率越大,即1+2>x+1,所以x=1,反应A(g)+2B(g)?C(g)+D(g)的K=c(C)×c(D)c(A)×c2(B),
故答案为:1;c(C)×c(D)c(A)×c2(B);
②由图可知,A的反应速率为2.0mol/L-0.78mol/Lt1s=1.22t1mol/(L?s),则由反应速率之比等于化学计量数之比,B的反应速率为1.22t1mol/(L?s)×2=2.44t1mol/(L?s),
故答案为:2.44t1;
③因体积、温度不变,向甲容器中再充入2molA、4molB,则平衡正向移动,A的浓度大于原浓度时浓度,小于原平衡浓度的2倍,即0.78mol/L<c(A)<1.56mol/L,
故答案为:0.78mol/L;1.56mol/L;?
(2)该反应为放热反应,升高温度,平衡逆向移动,则由450℃升高为600℃,平衡逆向移动,K减小,故答案为:减小;
(3)A.升高温度,正逆反应速率均增大,且逆反应速率大于正反应速率,与图象一致,故A正确;
B.增大压强,平衡正向移动,正反应速率越大时,A的转化率越大,与图象一致,故B正确;
C.温度越大,平衡逆向移动,A的含量越大,与图象不符,故C错误;
D.温度高,反应速率大,时间少,且温度越大,平衡逆向移动,C的含量少,与图象一致,故D正确;
故答案为:ABD;
(4)A.该反应为反应前后压强不等的反应,则容器中压强不变,反应达到平衡,故A正确;
B.v?(B)(正)=2v(C)(逆)=2v(C)(逆),C的正逆反应速率相等,反应达到平衡,故B正确;
C.因气体的总质量不变,体积不变,则容器中密度不变,不能利用密度判断平衡,故C错误;?
D.c?(A)=c(D)取决于起始浓度和转化率,不能利用其判断平衡,故D错误;
故选AB.
本题解析:
本题难度:一般
2、选择题 某反应:2A(g) 3B(g)的各物质的浓度
3B(g)的各物质的浓度
参考答案:
本题解析:
本题难度:一般
3、选择题 少量铁粉与100ml?0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O?②加NaOH固体?③滴入几滴浓盐酸?④加CH3COONa固体⑤加NaCl溶液?⑥滴加几滴硫酸铜溶液?⑦升高温度(不考虑盐酸挥发)⑧改用10ml?0.1mol/L的盐酸.
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③⑥⑦⑧
参考答案:①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,反应速率加快;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量;
⑦升高温度,反应速率加快;
⑧改用浓度大的盐酸,反应速率加快.
故选C.
本题解析:
本题难度:简单
4、选择题 反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为
4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率为
A.0.01mol/(L·s)
B.0.008 mol/(L·s)
C.0.003mol/(L·s)
D.0.002mol/(L·s)
参考答案:D
本题解析:反应速率通常用单位时间内浓度的变化量来表示,所以NO的反应速率为
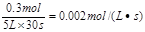 。答案选D。
。答案选D。
本题难度:简单
5、选择题 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6mol∕L,现有下列几种说法:
①用物质A表示的反应平均速率为0.3mol∕(L·s)②用物质B表示的反应的平均速率为0. 6 mol∕(L·s)③2s时物质A的转化率为70%?④2s时物质B的浓度为0. 7mol-L-l其中正确的是
A.③④
B.②③
C.①④
D.①③
参考答案:C
本题解析:V(C)=ΔC∕Δt=(0.6mol∕L)∕2s=0.3mol∕(L·s).根据同一化学反应各物质的速率关系:V(A) :V(B) :V(C)=2:1:2可得V(A)=" V(C)=" 0.3mol∕(L·s).①正确。V(B) =(1∕2)×V(C)= (1∕2)×0.3mol∕(L·s)="0.15" mol∕(L·s) ②错误。③2s时物质A的转化率是:{0.3mol∕(L·s) ×2s }∕(4mol÷2L) ×100%=30%.错误。④2s时物质B的浓度为(2mol÷2L)- 0.15 mol∕(L·s) ×2s="0.7" mol∕L。正确。
本题难度:一般