|
高考化学知识点总结《物质的量》试题预测(2019年最新版)(二)
2019-06-25 23:32:08
【 大 中 小】
|
1、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.3.2g由O2和O3组成的混合物中含有氧原子的数目为0.2NA
B.0.1mol苯中含有碳碳双键的数目为0.3 NA
C.标准状况下,11.2L三氯甲烷中含有分子的数目为0.5 NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4 NA
|
参考答案:A
本题解析:A.O原子的相对原子质量是16,所以3.2g由O2和O3组成的混合物中含有氧原子的物质的量是0.2mol,原子个数为0.2NA,正确;B.在苯分子中不存在碳碳双键,是一种介于碳碳单键和碳碳双键之间的一种特殊的化学键,因此该说法是错误的;C.标准状况下,三氯甲烷是液体,不能使用气体摩尔体积,错误;D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.2NA,错误。
考点:考查阿伏伽德罗常数的计算的知识。
本题难度:一般
2、填空题 将CO2通入NaOH溶液中,所得产物随通入的CO2的物质的量的不同而不同。完成下列填空。
(1)250 mL 1 mol/L的NaOH溶液,最多可吸收CO2?L(标准状况下)。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,将所得溶液蒸干,计算所得固体中各成分的物质的量。
向未知浓度、体积为V L的 NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体。
(3)若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1 g 白色沉淀。
①根据以上数据,用代数式表示CO2的体积V(CO2)=?。
②根据以上数据,推理计算出NaOH溶液的浓度范围。
(4)写出确定NaOH浓度的实验步骤,并用代数式表示NaOH溶液的浓度。(设计实验方案时,只能用题中提供的CO2和NaOH溶液,不得使用其它化学试剂。)
实验步骤:?。c(NaOH)=?。
参考答案:(1)5.6 L (1分)
(2)Na2CO3? 0.1 mol ;? NaOH? 0.3 mol(4分)
(3)①V(CO2)=0.224m1 L? 2分)?②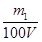 ≤ c(NaOH) ≤ ≤ c(NaOH) ≤ 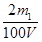 (每种情况各1分,共3分) (每种情况各1分,共3分)
(4)取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。(2分)
c(NaOH)= ?mol/L(2分) ?mol/L(2分)
或者:取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。(2分)
c(NaOH)=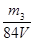 mol/L(2分)?(其它合理答案也给分) mol/L(2分)?(其它合理答案也给分)
本题解析:(1)250 mL 1 mol/L的NaOH溶液中氢氧化钠的物质的量为0.25mol,则根据方程式NaOH+CO2=NaHCO3可知,最多可吸收CO2的物质的量为0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L。
(2)向250 mL 2 mol/L的NaOH溶液中通入一定量CO2,溶液增重4.4 g,这说明参加反应的CO2的质量是4.4g,物质的量为0.1mol。氢氧化钠的物质的量为0.5mol,因此根据反应式2NaOH+CO2=Na2CO3+H2O可知氢氧化钠是过量的,所以所得固体为氢氧化钠和碳酸钠的混合物,其中碳酸钠0.1mol,氢氧化钠是0.5mol-0.1mol×2=0.3mol。
(3)①生成物不论是碳酸钠还是碳酸氢钠均能与氢氧化钙反应生成碳酸钙白色沉淀,则根据碳元素守恒可知CO2的物质的量是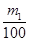 mol,在标准状况下的体积为 mol,在标准状况下的体积为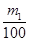 mol×22.4L/mol=0.224m1 L。 mol×22.4L/mol=0.224m1 L。
②如果生成物只有NaHCO3时,则根据原子守恒可知c(NaOH)= 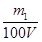 ;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)= ;当生成物只有Na2CO3时,同样依据原子守恒可知c(NaOH)= 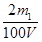 ;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以: ;当生成物是Na2CO3和NaHCO3时,消耗NaOH在上述两者之间。所以: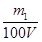 ≤ c(NaOH) ≤ ≤ c(NaOH) ≤ 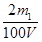 。 。
(4)要测定氢氧化钠溶液的浓度,则可以将其转化为碳酸氢钠,然后通过称量其质量得出氢氧化钠的质量,进而得出其浓度,或者计算参加反应的二氧化碳质量,进而得出氢氧化钠的物质的量,所以正确的实验步骤可以为:取V L NaOH溶液,称量,缓缓向其中通入CO2直至恒重,称量。测得其增重为m3 g。由于增加的质量即为参加反应的CO2质量,所以根据原子守恒可知碳酸氢钠的物质的量为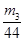 ,则氢氧化钠的物质的量也是 ,则氢氧化钠的物质的量也是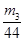 ,所以其浓度为 ,所以其浓度为 。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为 。或者取V L NaOH溶液,缓缓向其中通入过量的CO2,充分反应后减压低温蒸发溶液,得固体NaHCO3,称其质量为m3 g。则碳酸氢钠的物质的量为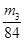 ,则根据原子守恒可知氢氧化钠的物质的量也是 ,则根据原子守恒可知氢氧化钠的物质的量也是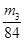 ,所以其浓度为 ,所以其浓度为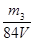 。 。
本题难度:一般
3、选择题 由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的个数之比为
[? ]
A.1:1
B.1:2
C.2:1
D.1:3
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列溶液中的Cl-浓度与100mL1mol?L-1MgCl2溶液中的Cl-浓度相等的是( )
A.200mL1mol?L-1KCl溶液
B.50mL1mol?L-1CaCl2溶液
C.150mL2mol?L-1NaCl溶液
D.50mL1mol?L-1AlCl3溶液
参考答案:100mL1mol?L-1MgCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(MgCl2)=2mol/L,
A、200mL1mol?L-1KCl溶液中Cl-的物质的量浓度C(Cl-)=C(KCl)=1mol/L,故A错误;
B、50mL1mol?L-1CaCl2溶液中Cl-的物质的量浓度C(Cl-)=2C(CaCl2)=2mol/L,故B正确;
C、150mL2mol?L-1NaCl溶液中Cl-的物质的量浓度C(Cl-)=C(NaCl)=2mol/L,故C正确;
D、50mL1mol?L-1AlCl3溶液中Cl-的物质的量浓度C(Cl-)=3C(AlCl3)=3mol/L,故D错误;
故选:BC.
本题解析:
本题难度:简单
5、填空题 等质量的氧气(O2)和臭氧(O3),物质的量之比为 ,所含氧原子的个数之比为
参考答案:3:2 、 1:1
本题解析:根据n=m/M可知在质量相等的条件下,物质的量和摩尔质量成反比,即二者的物质的量之比是48
本题难度:一般
|