1、选择题 常温下,将NaHY晶体加入水中溶解,得到0.1 mol/L NaHY溶液,下列叙述正确的是(? )
A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y)
B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-)
C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性
D.将NaHY晶体加入水中一定能促进水的电离
参考答案:A
本题解析:A项,溶液pH=4,说明HY-电离程度大于水解程度,故c(Y2-)>c(H2Y),同时考虑水电离出H+,故c(H+)>c(Y2-),A正确;
B项,虽然溶液呈碱性,但OH-主要来源于HY-的水解反应,但水解反应的程度很微弱,故c(HY-)>c(OH-),B错误;
C项,由电荷守恒c(Na+)+c(H+)=2c(Y2-)+c(OH-)+c(HY-),物料守恒c(Na+)=c(HY-)+ c(Y2-)+c(H2Y),可得c(H+)+c(H2Y)=c(OH-)+c(Y2-),无法说明NaHY的水溶液为碱性,C错误;D项,若NaHY溶液呈酸性,则对水的电离起抑制作用,D错
本题难度:一般
2、选择题 向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是? (? )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
参考答案:C
本题解析:若醋酸与氢氧化钾等体积混合,两者恰好完全反应生成醋酸钠和水;此时溶液中粒子关系为,电荷守恒:c(K+)+c(H+)=c(OH-)+c(CH3COO-),质量守恒:c(CH3COOH)+c(CH3COO-)=c(K+),质子守恒:c(OH-)= c(H+) +c(CH3COOH);所以
A正确,Va>Vb时:醋酸过量,即有c(CH3COOH)+c(CH3COO-)>c(K+);B正确,Va=Vb时:由质子守恒得c(CH3COOH)+c(H+)=c(OH-);C错,Va<Vb时:KOH过量,c(K+)>c(CH3COO-)>c(OH-)>c(H+);D正确,由电荷守恒可得,任意溶液中c(K+)+c(H+)=c(OH-)+c(CH3COO-);
本题难度:一般
3、选择题 下列过程或现象与盐类水解无关的是
A.向Na2CO3溶液中滴加酚酞试液变红色
B.实验室保存硫酸亚铁溶液时加入少量铁粉
C.加热FeCl3溶液颜色会变深
D.KAl(SO4)2·12 H2O可用于净水
参考答案:B
本题解析:A.Na2CO3+ H2O NaOH+NaHCO3。水解产生了NaOH使溶液显碱性,所以滴加酚酞试液变红色。不符合题意。错误。B.硫酸亚铁在空气中容易被氧化为Fe3+,实验室保存硫酸亚铁溶液时加入少量铁粉加入Fe粉是为了2Fe3++Fe=3Fe2+,为了防止硫酸亚铁溶液变质。这与盐的水解无关。符合题意。正确。C.FeCl3是强酸弱碱盐,盐的水解反应是酸碱中和反应的逆反应,酸碱中和反应是放热反应,所以盐的水解反应是吸热反应。升高温度促进盐的水解。所以加热FeCl3溶液会使更多的Fe3+发生水解反应得到氢氧化铁胶体,因此颜色会变深。不符合题意。错误。D.KAl(SO4)2·12 H2O电离产生的Al3+发生水解反应:Al3++3H2O
NaOH+NaHCO3。水解产生了NaOH使溶液显碱性,所以滴加酚酞试液变红色。不符合题意。错误。B.硫酸亚铁在空气中容易被氧化为Fe3+,实验室保存硫酸亚铁溶液时加入少量铁粉加入Fe粉是为了2Fe3++Fe=3Fe2+,为了防止硫酸亚铁溶液变质。这与盐的水解无关。符合题意。正确。C.FeCl3是强酸弱碱盐,盐的水解反应是酸碱中和反应的逆反应,酸碱中和反应是放热反应,所以盐的水解反应是吸热反应。升高温度促进盐的水解。所以加热FeCl3溶液会使更多的Fe3+发生水解反应得到氢氧化铁胶体,因此颜色会变深。不符合题意。错误。D.KAl(SO4)2·12 H2O电离产生的Al3+发生水解反应:Al3++3H2O Al(OH)3(胶体)+3H+.Al(OH)3胶体表面积大,吸附力强,能够吸附水中的悬浮物使之变为沉淀除去,所以可用于净水。不符合题意。错误。
Al(OH)3(胶体)+3H+.Al(OH)3胶体表面积大,吸附力强,能够吸附水中的悬浮物使之变为沉淀除去,所以可用于净水。不符合题意。错误。
本题难度:一般
4、选择题 物质的量相同的下列溶液中,含粒子种类最多的是()
A.CuSO4
B.Mg(NO3)2
C.KH2PO4
D.NaCl
参考答案:C
本题解析:KH2PO4====K++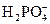
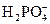 +H2O====H3PO4+OH-,
+H2O====H3PO4+OH-,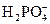
 H++
H++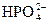
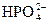
 H++
H++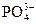
本题难度:简单
5、选择题 对于0.1mol?L-1(NH4)2SO4溶液,下列说法正确的( )
A.溶液中存在电离平銜:(NH4)2SO4?NH4++SO42-
B.向溶液中滴加少量浓硫酸,c(NH4+)、c(SO42-)均增大
C.加水稀释,溶液中所有离子的浓度均减小
D.溶液中:c(SO42-)=2c(NH4+)+2c(NH3?H2O)
参考答案:A、硫酸铵是强电解质能完全电离,用等号连接,即(NH4)2SO4═NH4++SO42-,故A错误;
B、向溶液中滴加少量浓硫酸,电离出氢离子和硫酸根离子,其中氢离子对铵根离子的水解平衡NH4++H2O?NH3?H2O+H+产生抑制作用,所以c(NH4+)、c(SO42-)均增大,故B正确;
C、加水稀释对水解平衡NH4++H2O?NH3?H2O+H+起到促进作用,但是稀释过程会导致溶液体积增大,所以酸性减弱,但是氢氧根离子浓度会增大,故C错误;
D、该溶液中的物料守恒:2c(SO42-)=c(NH4+)+c(NH3?H2O),故D错误.
故选:B.
本题解析:
本题难度:一般