1、填空题 ⑴下列物质属于非电解质的是?,属于弱电解质的是?(填序号)。
①氨水? ②SO2? ③CI2? ④次氯酸? ⑤BaSO4?⑥乙醇? ⑦H2O? ⑧NaHCO3
⑵用浓度为0.1 mol·L-1标准盐酸滴定氢氧化钠溶液时,以下操作会使结果偏低的是
?(填序号)。
①锥形瓶用待测液润洗? ②酸式滴定管读数是滴前仰视滴后俯视?
③配制氢氧化钠溶液时混有碳酸钠? ④酸式滴定管未用标准液润洗
(3) 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,写出反应的离子方程式:?;此时溶液呈?性(填“酸性”,“中性”或“碱性”),原因:?。
参考答案:⑴ ②⑥,? ④⑦? ⑵ ②③
(3)AI3++2SO42-+2Ba2++4OH-=2BaSO4↓+AIO2-+2H2O?碱? KAIO2是强碱弱酸盐水解显碱性
本题解析:(1)溶于水和在熔融状态下,都不能自身电离出阴阳离子的化合物是非电解质,所以属于非电解质的是②⑥;在溶液中不能完全电离,存在电离平衡的电解质是弱电解质,属于属于弱电解质的是④⑦。
(2)根据 可知,若锥形瓶用待测液润洗,则消耗盐酸的体积偏大,测定结果偏高;酸式滴定管读数是滴前仰视滴后俯视,则消耗盐酸的体积减小,测定结果偏低;等质量的碳酸钠消耗的盐酸少,属于配制氢氧化钠溶液时混有碳酸钠时,消耗盐酸的体积减小,测定结果偏低;酸式滴定管未用标准液润洗,则盐酸被稀释,消耗盐酸的体积偏大,测定结果偏高,属于答案选②③。
可知,若锥形瓶用待测液润洗,则消耗盐酸的体积偏大,测定结果偏高;酸式滴定管读数是滴前仰视滴后俯视,则消耗盐酸的体积减小,测定结果偏低;等质量的碳酸钠消耗的盐酸少,属于配制氢氧化钠溶液时混有碳酸钠时,消耗盐酸的体积减小,测定结果偏低;酸式滴定管未用标准液润洗,则盐酸被稀释,消耗盐酸的体积偏大,测定结果偏高,属于答案选②③。
(3)SO42-恰好沉淀完全时,生成的是偏铝酸钾,所以反应的离子方程式是
AI3++2SO42-+2Ba2++4OH-=2BaSO4↓+AIO2-+2H2O。由于生成的KAIO2是强碱弱酸盐水解,因此溶液显碱性。
本题难度:一般
2、填空题 (6分)写出下列盐水解的离子方程式:
① CH3COONa?
② (NH4)2SO4?
③ NaHCO3?
参考答案:(6分)(1)①CH3COO-+H2O CH3COOH+OH-?②NH4++H2O
CH3COOH+OH-?②NH4++H2O NH3·H2O+H+
NH3·H2O+H+
③HCO3-+H2O H2CO3+OH-(以上每空2分)
H2CO3+OH-(以上每空2分)
本题解析:略
本题难度:一般
3、填空题 已知某溶液中只存在OH-、H+、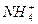 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(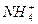 )>c(H+)>c(OH-)②c(Cl-)>c(
)>c(H+)>c(OH-)②c(Cl-)>c(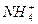 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(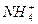 )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(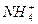 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶液是_______________,上述四种离子的浓度的大小顺序为_______________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_______________;若上述关系中④是正确的,则溶液中的溶质是_______________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好成中性,则混合前c(HCl)_________c(NH3·H2O)(填“大小”“小于”或“等于”)。
参考答案:(1)NH4Cl①(2)NH4Cl和NH3·H2ONH4Cl和HCl(3)小于
本题解析:据题意四种离子两两结合可得NH4Cl、NH3·H2O、HCl三种溶质。
(1)若溶液只溶解一种溶质,只有NH4Cl作为溶质时,溶液中才同时存在以上四种离子。因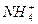 存在微弱的水解反应
存在微弱的水解反应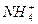 +H2O
+H2O NH3·H2O+H+,c(
NH3·H2O+H+,c(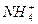 )减小,c(H+)>c(OH-),故溶液中c(Cl-)>c(
)减小,c(H+)>c(OH-),故溶液中c(Cl-)>c(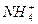
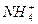 )>c(H+)>c(OH-)。
)>c(H+)>c(OH-)。
(2)若溶液中存在c(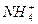 )>c(Cl-)>c(OH-)>c(H+),由c(OH-)>c(H+)可知溶液呈碱性,故溶液可由NH4Cl和NH3·H2O混合而得,即溶质为NH4Cl和NH3·H2O;若溶液中存在c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+),由c(OH-)>c(H+)可知溶液呈碱性,故溶液可由NH4Cl和NH3·H2O混合而得,即溶质为NH4Cl和NH3·H2O;若溶液中存在c(Cl-)>c(H+)>c(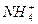 )>c(OH-),由c(H+)>c(
)>c(OH-),由c(H+)>c(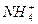 )可知溶液的酸性大于纯NH4Cl溶液的酸性,故溶液可由NH4Cl和盐酸混合而得。
)可知溶液的酸性大于纯NH4Cl溶液的酸性,故溶液可由NH4Cl和盐酸混合而得。
(3)若NH3·H2O和盐酸等体积混合后,溶液呈中性,则有c(H+)=c(OH-),c(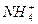 )=c(Cl-)n(
)=c(Cl-)n(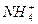 )=n(Cl-),因溶液中有未反应的NH3·H2O,则混合前n(NH3·H2O)>n(HCl)c(NH3·H2O)>c(HCl)。
)=n(Cl-),因溶液中有未反应的NH3·H2O,则混合前n(NH3·H2O)>n(HCl)c(NH3·H2O)>c(HCl)。
本题难度:简单
4、选择题 下列微粒的浓度关系一定正确的是
A.醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c (Na+)>c(H+)>c(OH一)
B.常温下,物质的量浓度相等的①(NH4)2SO4、②(NH4)2Fe (SO4)2、③NH4HSO4、④NH4C1溶液中c(NH4+)的大小顺序为:②>①>③>④
C.pH=3的盐酸与pH=ll的氨水等体积混合液中:c(H+)=c(OH一)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH一)+c(HA一)+c(A2-)
参考答案:B
本题解析:A、当溶液中醋酸钠的浓度远远大于醋酸的浓度时,溶液中c(Na+)>c(CH3COO-),故A错误;
B、等温、等物质的量浓度的铵盐溶液中,①②中铵根离子浓度大于③④。②中亚铁离子抑制铵根离子水解,所以②中铵根离子浓度大于③。③中氢离子抑制铵根离子水解,所以③中铵根离子浓度大于④,所以这四种溶液中铵根离子浓度大小顺序:②>①>③>④,故B正确;
C、pH=3的盐酸与pH=ll的氨水,氨水的物质的量浓度大于盐酸,所以等体积混合,氨水过量,溶液呈碱性,故C错误;
D.根据电荷守恒得c(H+)+ c(Na+)=c(OH一)+ c(HA一)+2c(A2-),故D错误,答案选B。
本题难度:一般
5、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
参考答案:D
本题解析:根据题意可知,二者恰好反应生成氨水和氯化钠,氯化钠是强电解质,氨水是弱碱,存在电离平衡,溶液显碱性,所以正确的答案选D。
点评:本题主要考查浓度相同的强弱电解质在溶液中离子浓度大小的比较。
本题难度:一般