1、选择题 下图所示各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )。

A.⑤②①③④
B.④③①②⑤
C.⑤④②①③
D.③②④①⑤
参考答案:C
本题解析:判断金属腐蚀快慢,首先判断该金属是充当原电池还是电解池的电极,若是电解池的阳极,金属腐蚀速率最快,其次是充当原电池的负极腐蚀较快,而作为电解池的阴极和原电池的正极不被腐蚀。其中第⑤,Fe作为电解池的阳极,腐蚀最快,②③④均为原电池,第③中,Fe为正极,不被腐蚀,②④中Fe均为负极被腐蚀,Fe和Cu的金属活动性差别较Fe和Sn大,④中铁腐蚀较快,其腐蚀速率由快到慢的顺序为⑤④②①③。
本题难度:一般
2、选择题 钢铁在某酸雨区的潮湿空气中发生电化学腐蚀,其负极上的反应是?
A.O2+2H2O+4e-==4OH-
B.2H++2e-==H2
C.Fe-2e-==Fe2+
D.4OH--4e-==2H2O
参考答案:C
本题解析:金属的电化学腐蚀中金属都是失去电子,做负极,所以答案选C。
点评:该题是基础性试题的考查,也是高考中的常见考点。主要是考查学生对金属腐蚀的熟悉掌握程度,以及灵活运用原电池原理解决实际问题的能力,有助于培养学生的应试能力,提升学生的学科素养。
本题难度:简单
3、选择题 (10+6分)有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000 mL水,加入一定量的NaCl 固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm的细铁丝,将铁丝放入试管中,加入约? 10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如右下图。过一会儿:
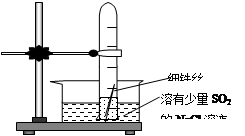
(1)观察到试管中的液面逐渐下降,这说明
在该条件下,铁丝发生了?腐蚀,
正极材料是?电极反应是?
(2)再过一段时间发现液面停止下降,并且开始逐渐
上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了
?腐蚀,正极的电极反应为?
①总反应为:?;①反应的产物极易被进一步氧化,生成红褐色物质,②该反应的化学方程式为:?若铁锈的组成为:Fe2O3·xH2O ,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:
③?
附加题(6分)(3)已知原来铁丝质量为2 g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为?g ,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气?mL,若x值为2,那么铁丝的质量应为?g(以上计算有效数字保留至小数点后三位)
参考答案:(1)析氢,C或炭?2H++2e―→ H2↑?
(2)吸氧?O2+ 4e―+ 2H2O → 4OH―
①? 2Fe +O2+ 2H2O = 2Fe(OH)2?(每空1分共6分)
② 4Fe(OH)2+O2+ 2H2O = 4Fe(OH)3? ( 2分)
③ 2Fe(OH)3=Fe2O3·xH2O +(3-x)H2O?( 2分)
附加题(每空2分,共6分)
(3)1.986 铁被溶解的物质的量即为氢气的物质的量,0.00025mol 即0.014g,2-0.014=1.986
6.72?被吸收氧气的体积应为? 5.6+1.12=6.72 mL
2.003? 1.986+增加了氧的质量(0.0003×32)+增加水的质量(0.0004×18)=2.0028
本题解析:略
本题难度:一般
4、选择题 铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是
[? ]
A.铁水龙头
B.铜水龙头
C.塑料水龙头
D.陶瓷水龙头
参考答案:B
本题解析:
本题难度:简单
5、选择题 如下图,铁腐蚀由快到慢的顺序为(电解质溶液为水)
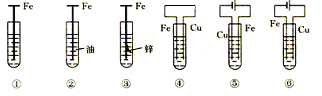
A.⑥>④>③>②>①>⑤
B.⑤>③>①>②>④>⑥
C.⑤>④>①>②>③>⑥
D.⑤>④>②>①>③>⑥
参考答案:C
本题解析:
正确答案:C
⑤铁作电解池的阳极腐蚀最快④铁作原电池的负极,加快腐蚀①在潮湿的空气中生锈②有油作保护③牺牲阳极的阴极保护⑥外加电流的阴极保护腐蚀最慢。
本题难度:一般