1、选择题 根据下列化学方程式:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3、2FeCl3+2KI=2FeCl2+2KCl+I2,判断各物质氧化性由大到小的顺序正确的是( )
A.I2>Cl2>FeCl3>KMnO4
B.KMnO4>Cl2>FeCl3>I2
C.Cl2>I2>FeCl3>KMnO4
D.FeCl3>KMnO4>Cl2>I2
参考答案:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中KMnO4做氧化剂,氧化HCl得到氧化产物CL2,氧化性KMnO4>CL2;
2FeCl2+Cl2=2FeCl3反应中Cl2是氧化剂,氧化FeCl2得到氧化产物FeCl3,氧化性Cl2>FeCl3;
2FeCl3+2KI=2FeCl2+2KCl+I2中,FeCl3是氧化剂,氧化KI为I2,氧化性FeCl3>I2;
综上所述氧化性由大到小的顺序为:KMnO4>Cl2>FeCl3>I2;
故选B.
本题解析:
本题难度:一般
2、选择题 已知:还原性HSO3->I-,氧化性IO3->?I2。在含 0.3?mol?NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
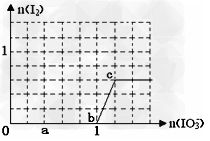
[? ]
A.0~b间的反应可用如下离子方程式表示:3HSO3-?+?IO3-=3SO42-?+?I-?+?3H+
B.a点时消耗NaHSO3的物质的量为0.12?mol
C.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
D.当溶液中I-与I2的物质的量之比为5∶2时,加入的KIO3为0.18mol
参考答案:D
本题解析:
本题难度:一般
3、选择题 有三个氧化还原反应:①2FeCl3+2KI 2FeCl2+2KCl+I2;
2FeCl2+2KCl+I2;
②2FeCl2+Cl2 2FeCl3;③2KMnO4+16HCl(浓)
2FeCl3;③2KMnO4+16HCl(浓) 2KCl+2MnCl2+5Cl2↑+8H2O。
2KCl+2MnCl2+5Cl2↑+8H2O。
若某溶液中有 Fe2+和I-共存,要除去I-而不影响Fe2+,可以加入的试剂是(?)
A.Cl2
B.FeCl3
C.HCl
D.KMnO4
参考答案:B
本题解析:略
本题难度:一般
4、填空题 分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O,据此作答:
(1)标出该反应中电子的转移方向和数目:
5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O
(2)该反应的氧化剂是 。
(3)该反应的氧化产物与还原产物的质量比是 。
(4)当反应生成0.3 mol Cl2时,则转移的电子的物质的量是 。
参考答案:(6分)(1)(2分)
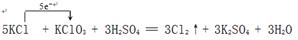 (双线桥表示也给分)
(双线桥表示也给分)
(2)KClO3(1分); (3)5∶1(1分); (4)0.5 mol(2分)
本题解析:根据方程式可知,在反应中氯化钾中氯元素的化合价从-1价升高到0价,氯酸钾中氯元素的化合价从+5价,降低到0价,所以氧化剂是氯酸钾。氧化产物和还原产物都是氯气,由于还原剂和氧化剂的物质的量之比是5:1,则反应的氧化产物与还原产物的质量比是5∶1。每生成3mol氯气,转移5mol电子,则当反应生成0.3 mol Cl2时,转移的电子的物质的量是0.5mol。
考点:考查氧化还原反应的有关计算和判断
点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念判断即可。有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
5、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.若氯酸分解所得混合气体lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-