1、选择题 已知下列反应的平衡常数:①H2(g)+S(s) H2S(g) K1; ②S(s)+O2(g)
H2S(g) K1; ②S(s)+O2(g)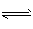 SO2(g) K2,
SO2(g) K2,
则反应③H2(g)+ SO2(g) O2(g)+ H2S(g)的平衡常数是
O2(g)+ H2S(g)的平衡常数是
[? ]
A. K1+K2
B. K1-K2
C. K1×K2
D. 
参考答案:D
本题解析:
本题难度:一般
2、简答题 硼酸(H3BO3)在食品、医药领域应用广泛.
(1)请完成B2H6气体与水反应的化学方程式:B2H6+6H2O=2H3BO3+______.
(2)在其他条件相同时,反应H3BO3+3CH3OH

B(OCH3)3+3H2O中,H3BO3的转化率(a)在不同温度下随反应时间(t)的变化见图,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是______
②该反应的△H______0(填“<”、“=”或“>”).
(3)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l)

[B(OH)4]-(?aq)+H+(aq)已知0.70mol?L-1?H3BO3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2.0×10-5mol?L-1,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)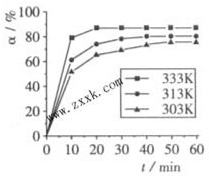
参考答案:(1)根据质量守恒定律,反应前后的B、O原子个数在反应前后相等,由氢原子守恒则产物只能是H2,故答案为:6H2;
(2)由图象可知,温度升高,H3BO3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O,故答案为:升高温度,反应速率加快,平衡正向移动;>;
(3)根据平衡常数的表达式K═[H+?]×[B(OH)4]-[H3BO3]═(2×10-5)20.7═5.7×10-10,故答案为5.7×10-10.
本题解析:
本题难度:一般
3、填空题 甲酸甲酯水解反应方程式为: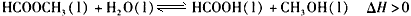
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表
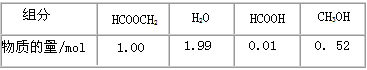
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图
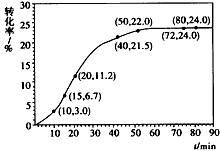
|
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表
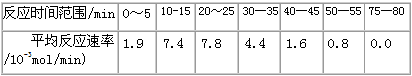
请计算15-20min范围内甲酸甲酯的减少量为________mol,甲酸甲酯的平均反应速率为________mol/min(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:___________________________________
(3)上述反应的平衡常数表达式为: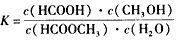 则该反应在温度T1下的K值为________________
则该反应在温度T1下的K值为________________
(4)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。______________________
参考答案:(1)0.045;9.0×l0-3
(2)该反应中用酸具有催化作用。 ①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大;③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
(3)0.14 (4)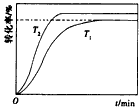
本题解析:
本题难度:一般
4、填空题 抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如图1:
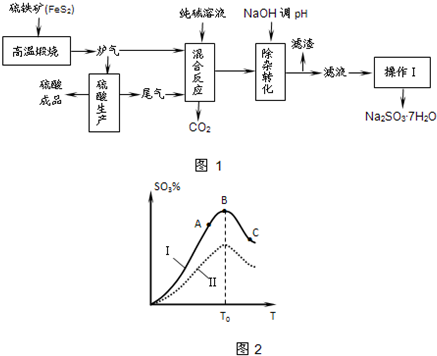
已知:①炉气、尾气中含有SO2;②混合反应中还溶解有少量Fe2O3、MgO等矿尘.
(1)煅烧1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为______.
(2)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为______(任写一个).
(3)用NaOH“除杂”时,主要的离子方程式为______(任写一个).
(4)通过“操作Ⅰ”可以得到亚硫酸钠晶体,写出主要操作步骤的名称:______
(5)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如图2曲线Ⅰ所示.下列判断正确的是______
A.该反应的正反应为放热反应
B.曲线Ⅰ上A、C两点反应速率的关系是:vA>vC
C.反应达到B点时,2v正(O2)=v逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,
若Ⅰ表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线.
参考答案:(1)FeS2燃烧生成二氧化硫与氧化铁,1molFeS2放出热量为853kJ,则FeS2燃烧的热化学方程式为4FeS2(S)+11O2(g)=8SO2(g)+2Fe2O3(s),△H=-3412?kJ?mol?-1.
故答案为:4FeS2(S)+11O2(g)=8SO2(g)+2Fe2O3(s),△H=-3412?kJ?mol?-1.
(2)SO2与纯碱(Na2CO3)溶液反应的方程式为SO2+Na2CO3=Na2SO3+CO2↑或2?SO2+Na2CO3+H2O=NaHSO3+CO2↑.
故答案为:SO2+Na2CO3=Na2SO3+CO2↑或2?SO2+Na2CO3+H2O=NaHSO3+CO2↑.
(3)合反应后的溶液中含有少量的Fe2+、Mg2+、HSO3-等.Fe2+、Mg2+、HSO3-等都与OH-发生反应.发生反应离子方程式为
Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O.
故答案为:Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O.
(4)从溶液中获得固体物质应加热蒸发、冷却结晶、过滤、洗涤干燥.
故答案为:加热蒸发、冷却结晶、过滤、洗涤干燥.
(5)由图象可知T0前反应未达平衡,T0时处于平衡状态,T0后升高温度平衡向逆反应移动.
A、T0后升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B、A未达平衡,B处于平衡状态,反应速率比A点高,T0后温度升高反应速率加快,平衡向逆反应移动,但比B点的速率高,所以:vA<vC,故B错误;
C、不同物质表示的正逆反应速率之比等于化学计量数之比,反应到达平衡状态,反应达到B点时,到达平衡状态,所以2v正(O2)=v逆(SO3),故C正确;
D、使用催化剂,加快反应速率,缩短到达平衡时间,但平衡不移动,用V2O5催化剂与Fe2O3作催化剂,到达平衡时三氧化硫的含量相同,故D错误.
故选:AC.
本题解析:
本题难度:一般
5、选择题 下列四个图象:以下反应中完全符合上述图象的是( ? )

A.N2(g)+3H2(g)?2?NH3?(g)△H<0
B.2SO3(g)?2SO2?(g)+3O2(g)△H>0
C.4NH3(g)+5O2?(g)═4NO(g)+6H2O(g)△H<0
D.2HI(g)?H2?(g)+I2(g)△H>0
参考答案:C
本题解析:
本题难度:一般