| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡常数》考点特训(2019年冲刺版)(八)
 参考答案:A 本题解析: 本题难度:一般 3、填空题 500℃、20Mpa时,将3mol?H2和1mol?N2置于一容积为2L的密闭容器中发生反应,则反应达到平衡时,平衡常数表达式K=______,此时,增加N2的量,平衡常数将______(填“增大”“减小”或“不变”) 参考答案:因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=C2(NH3)C3(H2)C(N2),而化学平衡常数的大小与温度有关,与反应物和生成物的浓度无关,故答案为:C2(NH3)C3(H2)C(N2);不变. 本题解析: 本题难度:一般 4、简答题 已知25℃时部分弱电解质的电离平衡常数数据如下表:
(1)物质的量浓度均为0.1mol?L-1的四种溶液:a.CH3COONa?b.Na2CO3?c.NaClO d.NaHCO3; pH由小到大的排列顺序是______(用字母表示) (2)常温下,0.1mol?L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是______(填序号) A.c(H+)?B.c(H+)/c(CH3COOH)C.c(H+)?c(OH-)D.c(OH-)/c(H+) 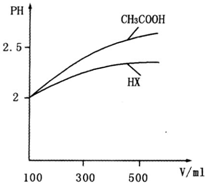 (3)体积均为100mL?pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.理由是:______. (4)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=______mol?L-1(填精确值),c(CH3COO-)/c(CH3COOH)=______. 参考答案:(1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大, 本题解析: 本题难度:一般 5、选择题 反应:X(气)+3Y(气)?2Z(气)+热量,在不同温度、不同压强(P1>P2)下,达到平衡时,混和气体中Z的百分含量随温度变化的曲线应为( ? ) 参考答案:C 本题解析: 本题难度:一般 | ||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质组成与.. | |