|
|
|
高考化学知识点总结《原电池原理》试题巩固(2019年最新版)(三)
2019-06-28 20:21:10
【 大 中 小】
|
1、填空题 (13分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 ,形成化学键要 。
(2)在生产和生活中经常遇到化学能与电能的相互转化。
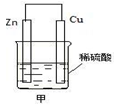
如图甲是将 能转化为 能的装置,负极电极反应式为 ,发生______反应(填“氧化”或“还原”,下同)。正极现象 ,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出 g 氢气。
2、选择题 某原电池结构如图所示,下列有关该原电池的说法正确的是( )
A.能将电能转换成化学能
B.电子从碳棒经外电路流向铁棒
C.碳棒发生氧化反应
D.总反应为Fe+H2SO4=FeSO4+H2↑
| 
3、选择题 下列关于实验现象的描述不正确的是 ( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
|
4、选择题 化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.KSP(AgCl) > KSP(AgI) ,由此可以判断AgCl(s) + I-(aq)= AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN) < Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
5、选择题 银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2 Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是
Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是
[? ]
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn

 Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是
Ag2O+Zn+H2O在此电池放电时,负极上发生反应的物质是