1、填空题 某班学生在老师指导下探究氮的化合物的某些性质。
(1)同学甲在实验室利用下列装置制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:
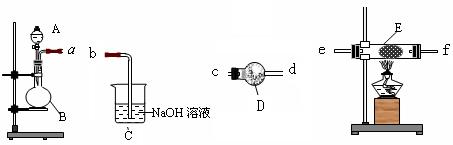
①仪器B的名称:_____________。B内只需加入一种固体试剂,该试剂的名称为__________,B中能产生氨气和氧气混合气体的原因(结合化学方程式回答)_?__。
②按气流方向连接各仪器?(填接口字母)
(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下:
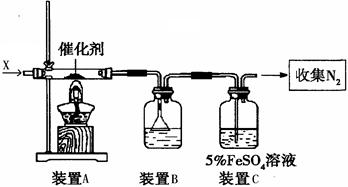
①装置C的作用可能是 ____________
②若进入装置A的NO共268.8mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为?
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
t/s
| 0
| 500
| 1000
|
c(N2O3)/mol·L-1
| 5.00
| 3.52
| 2.48
|
?计算在t=500s时,NO2的反应速率为?
参考答案:(1)①圆底烧瓶?过氧化钠?2Na2O2+2NH3·H2O=4NaOH+O2↑+2NH3↑过氧化钠与氨水反应消耗水,增大了氨水浓度;过氧化钠与水反应生成氧气,反应放热减小了氨气的溶解度;过氧化钠与水反应生成NaOH,电离出OH—,使NH3·H2O的电离平衡逆向移动(3分)?②a c d e f b或a c d f e b
(2)①吸收未反应的NO?②85%(3分)
(3)0.00592mol·L-1·s-1(不写单位不得分)
本题解析:略
本题难度:一般
2、实验题 ( 12分 ) ( 1 ) 在试管里加入2 mL蛋白质溶液,然后加入2 mL甲醛溶液,可以看_____,把少量沉淀放入盛有蒸馏水的试管里,沉淀 __________ 。
( 2 ) 1995年美国科学家Lagow报道,他制得了碳的第四种同素异形体——链式炔碳。…—C≡C—C≡C—C≡C—C≡C—…有300~500个碳原子,该物质很活泼。回答下列问题:
①链式炔碳的熔点,估计比石墨 ________ ( 填“高”或“低” ) 。
②推测链式炔碳C300经适当处理可得含多个C≡C的链状化合物C300H296,该分子中含C≡C最多可达个 ________ 。
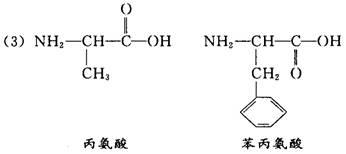
( 3 ) 高分子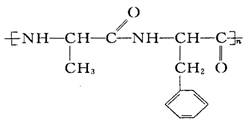 水解产物的分子结构简式和名称分别是 __________________ ,______________________ 。
水解产物的分子结构简式和名称分别是 __________________ ,______________________ 。
参考答案:( 1 ) 有沉淀产生 不溶解
( 2 ) 低 76
本题解析:( 1 ) 考查蛋白质的性质,在加热、紫外线、X射线、强酸、强碱、重金属、甲醛、酒精、苯甲酸存在下变性,丧失了原有的性质。
( 2 ) 链式炔碳为分子晶体,熔沸点较低与烷烃 C300H602相比,氢原子数相差306,多一个C≡C少4个氢原子,所以应有76个C≡C。
本题难度:简单
3、选择题 下列关于研究物质性质的基本程序,排列顺序正确是
[? ]
a、观察物质的外观b、实验和观察c、解释及结论d、预测物质的性质
A.b a c d
B.a d b c
C.a b c d
D.d a b c
参考答案:B
本题解析:
本题难度:简单
4、填空题 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。请填空:
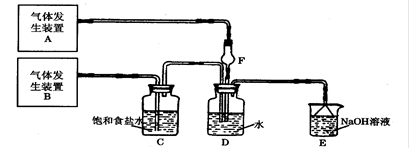
(1)D装置中主要反应的离子方程式为?,F仪器的作用是?。
(2)为验证通入D装置中的气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
a 氯化铁稀溶液? b 氯化亚铁溶液? c 硫氰化钾溶液?
d 苯酚溶液? e 品红溶液? f 酸性高锰酸钾溶液
①若Cl2过量:取适量D中溶液滴加至盛有?(选填一个符号)试剂的试管内,再加入?(选填一个符号)试剂,发生的现象是:?;
②若选用上述试剂中的一种再结合必要的操作就可以验证通入D装置中的气体是Cl2过量还是SO2过量,该试剂是?(选填一个符号)。必要的操作和结论是?。
参考答案:(共12分)(1)Cl2+SO2+2H2O=4H++2Cl―+SO42- (2分);?防倒吸(2分);
(2)① b (1分);? c(或d)(1分);?溶液呈红色(或紫色)(2分);
② e(2分);品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。(2分)
本题解析:(1)氯气具有氧化性,能把SO2氧化生成硫酸和盐酸,反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl―+SO42-。由于SO2易溶于水,也易与水反应,且溶解度较大会发生倒吸,则F装置的作用是防止倒吸。
(2)①若Cl2过量,则所得溶液具有强氧化性,能把亚铁离子氧化生成铁离子,据此可以通过检验铁离子来检验氯气是否过量,即答案选b、c或d。
②因氯气和二氧化硫都具有漂白性,则选择品红来检验是Cl2过量还是SO2过量,即答案选e。若品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该题的关键是明确物质的性质及发生的化学反应,并能灵活运用即可。
本题难度:一般
5、计算题 将固体MnC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化
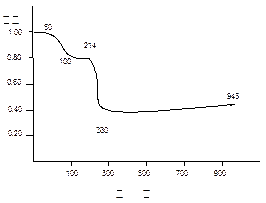
的关系如图所示(相对原子质量:H 1.0,? C 12.0,? O 16.0,? Mn 55.0 ):
纵坐标是固体的相对质量。
说出在下列五个温度区间各发生什么变化,并简述理由:
0~50℃;50~100℃;100~214℃;214~280℃;280~943℃
参考答案:0~50℃? MnC2O4·2H2O稳定区域? (1分)
50~100℃? MnC2O4·2H2O = MnC2O4 + 2H2O? (2分)
179? 143? 143/179=" 0.80?" (1分)
100~214℃? MnC2O4?稳定区域? (1分)
214~280℃? MnC2O4 =" MnO" + CO + CO2? (2分)
143? 71? 71/179 =" 0.40?" (1分)
280~943℃? 3MnO +1/2O2 = Mn3O4? 76.3/179 =" 0.43?" (2分)
本题解析:如果说上题最后一部分是“看表释义”,则本题是“看图识字”。试题的题面并没有说实验装置叫什么,是避免过多分散精力。这种仪器叫做热分析仪,本题涉及的是其中的热重分析。本题的解必须通过计算,计算的基础是图中的相对失重,要假设发生一个化学方程,然后进行失重的计算来论证,是否与题面的图中的实验数据相吻合。这种工作方法是实实在在的热重分析方法。当然,这种分析在很大程度上仍然有猜测的成分,因此最后的证实还要靠更多的分析手段,特别是热分解产物的结构分析(本题没有涉及)。
本题难度:一般