1、填空题 为了验证镁和铝的金属性强弱,某同学欲设计实验验证.提供的试剂有:镁带、铝条、水、盐酸、浓硫酸.
(1)所选试剂为______;
(2)发生反应的化学方程式为______;
(3)请简要叙述其操作过程及现象______.
参考答案:(1)金属镁和铝和盐酸反应产生氢气的速率不一样,可以证明金属的活泼性强弱,金属铝在常温下遇到浓硫酸发生钝化,不能用浓硫酸,故答案为:镁带、铝条、盐酸;
(2)金属镁和铝与盐酸反应分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,故答案为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑;
(3)将镁条和铝带分别放入盛有浓度相等的盐酸溶液中,观察产生氢气的速率,产生氢气的速率快的是金属镁,反之是金属铝,故答案为:将镁条和铝带分别放入盛有浓度相等的盐酸溶液中,观察产生氢气的速率,产生氢气的速率快的是金属镁,反之是金属铝.
本题解析:
本题难度:一般
2、实验题 (14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
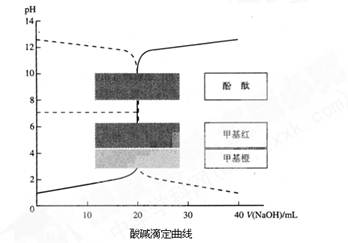
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中??(填“实线”或“虚线”)。
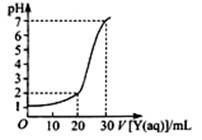
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是?和?。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于?(填仪器名称)中,用蒸馏水稀释10倍。
B.用?(填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入?(填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视?;终点现象是?。
②误差分析:下列操作中能使测定结果偏高的是?。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是?。
参考答案:(14分)
(1)虚线?(2分)?(2)0.09 mol·L?1? 0.03 mol·L?1?(每空2分)
(3)(A)250mL容量瓶(1分)
(B)酸式滴定管(1分),酚酞试液(1分)
①锥形瓶中溶液颜色的变化。(1分)
溶液由无色变为浅红色,且在30s内不褪色。(1分)
②a、b(2分)
③食醋稀释时,体积控制不当,实际稀释倍数大于理论释释倍数;试样量取体积偏小;滴定终点颜 色不足30s褪去;滴定结束后在碱式滴定管的尖嘴处有气泡;制造商加水过度稀释等。(1分)
本题解析:考查酸碱中和滴定
(1)向一定量的NaOH溶液中滴加HCl溶液时,混合溶液的pH逐渐减小,故符合虚线
(2)设X和Y的物质的量浓度分别CX、CY,根据图示可得到以下两等式:
0.01CX=0.03CY? 0.01=(0.01CX—0.02CY)/0.03
解得:CX=0.09 mol·L?1、CY=0.03 mol·L?1
(3)A:精确的配制、稀释溶液的容器为容量瓶
B:精确量取酸性液体可采用酸式滴定管;由于用强碱滴定弱酸,中和时溶液水解呈碱性,最好采用变色范围为碱性区域的指示剂,即酚酞
C:①酸碱滴定时,左手握活塞,右手旋转锥形瓶,两眼注视锥形瓶中溶液颜色的变化;
终点现象是溶液由无色变为浅红色,且在30s内不褪色
②a.蒸馏水消毒时一般用氯气,形成酸性物质,故将消耗的碱液偏多,测定结果偏高
b.盛NaOH溶液的碱式滴定管未用标准液润洗将使标准液的浓度偏小,标准液的体积偏大,测定结果偏高
c.滴定前读数正确,滴定终点时俯视读数,将使标准液的体积偏小,测定结果偏低
d.无影响
③制造商加水过度稀释等
本题难度:一般
3、填空题 (11分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探 究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度 / mol·L-1[来源][来源:][来源][来源:
| 溶液褪色所需时间 t / min
|
第1次
| 第2次
| 第3次
|
0.01
| 14
| 13
| 11
|
0.001
| 6
| 7
| 7
|
①计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化)。?
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:?
参考答案:(1)4?(3分)
(2)①(3分)反应开始时:c(KMnO4)=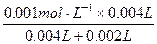 =0.00067 mol·L-1
=0.00067 mol·L-1
反应时间: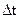 =
=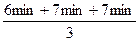 =6.7min?
=6.7min?
KMnO4的平均反应速率:
ν(KMnO4)=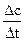 =
= =1×10-4 mol·L-1·min-1?
=1×10-4 mol·L-1·min-1?
②否(或:不可行)(2分)?取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。(3分)
本题解析:略
本题难度:简单
4、选择题 用氯气消毒过的自来水配制下列溶液时,会使所配的溶液的溶质发生变化的是(?)
①NaOH?②AgNO3?③Na2CO3?④NaBr?⑤KI
A.只有①②
B.只有①④⑤
C.只有②④⑤
D.①②③④⑤
参考答案:D
本题解析:氯气所配的自来水含有氯分子、次氯酸、氢离子、氯离子等离子,它们可与氢氧化钠、硝酸银、碳酸钠、溴化钠、碘化钾都发生反应。
本题难度:简单
5、选择题 一元硬币的外观有银白色的金属光泽,一些同学认为它可能是铁制成的。在讨论时,有同学提出:“我们可以先拿磁铁来吸一下。”就“拿磁铁来吸一下”这一过程而言,属于科学探究中的
[? ]
A.实验
B.比较
C.观察
D.分类
参考答案:A
本题解析:
本题难度:简单