1、实验题 (15 分) S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2 ℃CCl4+S2Cl2;② 2S+Cl2
℃CCl4+S2Cl2;② 2S+Cl2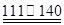 ℃S2Cl2。
℃S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2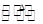 2SCl2。
2SCl2。
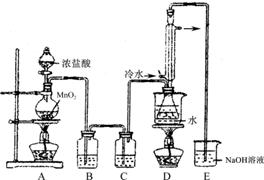
下列是几种物质的熔沸点和反应装置图
物质
| 沸点/℃
| 熔点/℃
|
S
| 445
| 113
|
CS2
| 47
| -109
|
CCl4
| 77
| -23
|
S2Cl2
| 137
| -77
|
(1)利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是?(填写以上两种反应原理的数字序号)
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是?。
(3)D装置中冷凝管的作用是?;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是?。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为?。
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和?。
(6)上图尾部装置不够完善,存在的问题是?。
2、实验题 (4分)某同学为探究碳酸钠的性质,进行了如下实验,请你按要求回答有关问题。
(1)配制100 mL 0.5 mol/L的Na2CO3溶液。该同学先用天平称量Na2CO3固体的质量,然后配制该溶液,要用到的玻璃仪器有量筒、烧杯、?、?。
(2)用pH试纸测所配溶液的pH,pH>7,说明Na2CO3溶液呈?(填“酸性”、“碱性”或“中性”);用试管取少量所配溶液,向溶液中滴加几滴酚酞试液,溶液变红,再用酒精灯加热,溶液的颜色变深,说明升高温度,对Na2CO3的水解有?作用。
3、实验题 利用铝热反应焊接钢轨的原理是2Al+Fe2O3 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入?溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有??;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
实验操作
| 预期现象和结论
|
 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。
| ?
|
步骤2:将步骤1的滤渣转移到烧杯B中,加入足量?,充分搅拌,过滤,洗涤。
| 有红色固体生成,说明粉末中含有
?。
|
步骤3:将步骤2的滤渣转移到烧杯C中,
?
?。
| ?
?
?,
说明粉末中含有Fe2O3。(1分)
|
?
4、实验题 (7分)实验室利用如图装置进行中和热的测定,请回答下列问题:
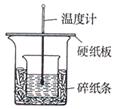
(1)在操作正确的前提下,提高中和热测定准确性的关键是?
(2)做1次完整的中和热测定实验,温度计需使用?次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么??
(3)请为本实验设计数据记录表格:
5、实验题 (15分)某兴趣小组用题27图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.