1、实验题 (15 分) S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2 ℃CCl4+S2Cl2;② 2S+Cl2
℃CCl4+S2Cl2;② 2S+Cl2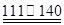 ℃S2Cl2。
℃S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2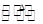 2SCl2。
2SCl2。
下列是几种物质的熔沸点和反应装置图
物质
| 沸点/℃
| 熔点/℃
|
S
| 445
| 113
|
CS2
| 47
| -109
|
CCl4
| 77
| -23
|
S2Cl2
| 137
| -77
|
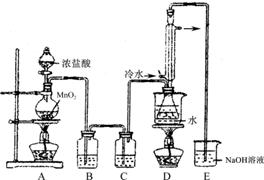
(1)利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是?(填写以上两种反应原理的数字序号)
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是?。
(3)D装置中冷凝管的作用是?;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是?。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为?。
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和?。
(6)上图尾部装置不够完善,存在的问题是?。
参考答案:(15 分)
(1)①。(2分)
(2)无水氯化钙或固体五氧化二磷。(2分)
(3)冷凝回流、导气。(各1分,共计2分)?蒸馏?(2分)
(4)2S2Cl2+2H2O=3S↓+SO2↑+4HCl(2分)
(5)控制浓盐酸的滴速不要过快(2分)
(6)在D和E之间增加干燥装置、尾气吸收要防止倒吸(3分,少一个扣2分)
本题解析:(1)图中D装置是液体与液体的反应,故反应原理是①。
(2)注意C装置中的固体不能与2Cl2反应,故装置C中可选用的固体试剂是无水氯化钙或固体五氧化二磷。
(3)D装置中冷凝管是冷凝Cl2的温度,故作用是冷凝回流、导气。CS2与S2Cl2沸点的相差很大,故分离的方法是蒸馏。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,说明生成了固体S和SO2气体,故方程式为2S2Cl2+2H2O=3S↓+SO2↑+4HCl。
(5)为了提高制得的产品S2Cl2的纯度,需要控制好温度和使反应物混合均匀充分反应,故填空为控制浓盐酸的滴速不要过快。
(6)E装置容易倒吸,故存在的问题是在D和E之间增加干燥装置、尾气吸收要防止倒吸。
点评:本题是有关实验方案的设计和评价的考查,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。
本题难度:一般
2、实验题 (4分)某同学为探究碳酸钠的性质,进行了如下实验,请你按要求回答有关问题。
(1)配制100 mL 0.5 mol/L的Na2CO3溶液。该同学先用天平称量Na2CO3固体的质量,然后配制该溶液,要用到的玻璃仪器有量筒、烧杯、?、?。
(2)用pH试纸测所配溶液的pH,pH>7,说明Na2CO3溶液呈?(填“酸性”、“碱性”或“中性”);用试管取少量所配溶液,向溶液中滴加几滴酚酞试液,溶液变红,再用酒精灯加热,溶液的颜色变深,说明升高温度,对Na2CO3的水解有?作用。
参考答案:
(1)容量瓶、玻璃棒? (2)碱性、促进作用
本题解析:略
本题难度:简单
3、实验题 利用铝热反应焊接钢轨的原理是2Al+Fe2O3 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入?溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有??;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
实验操作
| 预期现象和结论
|
 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。 步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。
| ?
|
步骤2:将步骤1的滤渣转移到烧杯B中,加入足量?,充分搅拌,过滤,洗涤。
| 有红色固体生成,说明粉末中含有
?。
|
步骤3:将步骤2的滤渣转移到烧杯C中,
?
?。
| ?
?
?,
说明粉末中含有Fe2O3。(1分)
|
?
参考答案:(1) NaOH (1分)? (2) Fe2O3
(3)(10分)
实验操作
预期现象和结论
步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,洗涤。
?
步骤2:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤。
有红色固体生成,说明粉末中含有Fe。(1分)
步骤3:将步骤3的滤渣转移到烧杯C中,加入足量3mol/L HCl,充分搅拌,再滴加少量20%KSCN。(2分)
固体部分溶解,溶液变血红色,说明粉末中含有Fe2O3。(1分)
本题解析:考查铝、铁及其化合物的性质及检验,铝热反应涉及物质无所谓是铁铝两金属单质及其对应的氧化物
(1)通过实验结论可知,通过该步骤来检验铝及其氧化物的存在:一般是通过用NaOH碱液来检验,涉及反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O,可通过是否有气体生成来判定是否有铝,固体是否溶解来判定是否有Al2O3
(2)Fe、Fe2O3、Al2O3三种物质中,已经确定Al2O3的存在,那么固体的组成无所谓就是三种情况:①Fe2O3、Al2O3②Fe、Al2O3③Fe、Fe2O3、Al2O3
(3)实验的主要目的是确定Fe、Fe2O3是否存在,依据所给部分信息可知
步骤1当然是溶解除去Al2O3
步骤2:结论有红色固体生成,说明是生成了铜,可知原样品中一定含有铁,将可溶性铜盐(最常用的就是硫酸铜溶液)置换所致
步骤3:很明显本步骤是要检验Fe2O3的存在,对于三价铁的检验,一般用KSCN溶液,故可用酸液将滤渣溶解后用KSCN来观察是否有血红色现象产生即可
点评:本题本质是对铁、铝及其化合物的检验,起点高,但落点较低,都是日常学生常见的习题;但综合性较高
本题难度:一般
4、实验题 (7分)实验室利用如图装置进行中和热的测定,请回答下列问题:
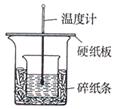
(1)在操作正确的前提下,提高中和热测定准确性的关键是?
(2)做1次完整的中和热测定实验,温度计需使用?次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么??
(3)请为本实验设计数据记录表格:
参考答案:(7分)(1)保温(1分)
(2)3次?(1分)不同意,因为不同的温度计误差不同。(2分)
(3)(3分)
温度
实验次数
起始温度t1/℃
[
终止温度
t2/℃
?
温度差
(t2—t1)/℃
HCl
NaOH
平均值
1
?
?
?
?
?
2
?
?
?
?
?
3
?
?
?
?
?
本题解析:略
本题难度:一般
5、实验题 (15分)某兴趣小组用题27图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为___________________.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是_________反应(填“吸热”或“放热”).
(3)为保证在装置4中观察到红棕色气体,装置3应装入_________;若取消3,在4中仅观察到大量白烟,原因是___________________.
(4)为实现氨催化氧化,也可用装置5替换装置_________(填装置代号);化合物X为_________(只写一种),Na2O2的作用是___________________.
参考答案:
(1)4NH3+5O2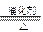 4NO+6H2O
4NO+6H2O
(2)放热
(3)浓硫酸;生成的NO与O2反应生成NO2;NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
(4)I;NH4Cl,与HCl反应生成氧气
本题解析:略
本题难度:简单