1、填空题 某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发 生反应,设计并完成了如图所示
生反应,设计并完成了如图所示
实验。?
X溶液是?,滴入的量一般为?。
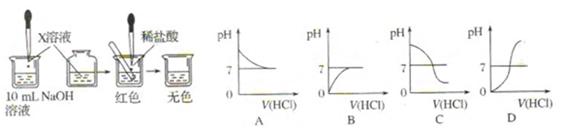
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的 试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法:?。
②上图中哪个图像符合该同学的记录?(填序号)。
(3)你认为甲、乙两位同学的实验中,?(填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:?。
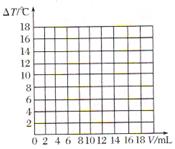
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
加入盐酸的
体积( )/mL )/mL
| 2
| 4
| 6
| 8
| 10
| 12
| 14
| 16
| 18
|
溶液温度上升
| 5.2
| 9.6
| 12.0
| 16.0
| 18.2
| 16.7
| 15.7
| 14.7
| 13.7
|
就此实验回答:
(4)盐酸和氢氧化钠的反应是?(填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温 度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
 ?
?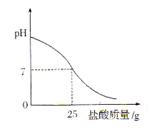
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为?。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填):?。
参考答案:Ⅰ.(1)酚酞,1~2滴;(2)①用干净的玻璃棒蘸取待测液滴到pH试纸上,半分钟后,将试纸的颜色与标准比色卡对照,读出溶液的pH即可。
②C?(3)乙同学。甲同学的实验不能充分说明盐酸的氢氧化钠发生了反应,有可能是盐酸和红色物质反应生成了无色物质。乙同学的实验,随着滴加盐酸,溶液的pH由大于7逐渐减少到7,这充分证明溶液中的氢氧化钠因反应而消耗了;
Ⅱ.(1)放热反应;(2)曲线见下图;Ⅲ.(1)29.2%;(2)盐酸具有挥发性。
本题解析:略
本题难度:一般
2、填空题 欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:
①反应中除生成NO2气体外还会有少量的NO生成;
②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。
为完成测定并验证有NO生成,有人没计如F实验装置:
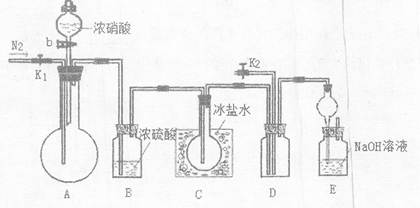
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是?。
(2)装置中B瓶的作用是?。
(3)实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是?;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入____(填“冷”或“热”)的氧气,其原因是:____
(4)若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需加入过量的____(填一种物质的化学式,下同)溶液,过滤、洗涤、干燥称量?的质量就可达目的。(已知Cu(OH)2与AgOH类似,也可以溶于过量的氨水而形成溶液。)
参考答案:
本题解析:略
本题难度:一般
3、实验题 (14分)某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是?,其作用是?。
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是?。B中应放置的液体是?(填字母)。
a.水 b.酸性KMnO4?c.浓溴水? d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热, 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是?
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是?(填字母)。
a.铁粉? b.银粉? c.碳酸氢钠溶液? d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是
?(填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
参考答案:

本题解析:略
本题难度:简单
4、实验题 (12分)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a—无水乙醇(沸点:78℃);b—铜丝;c—无水硫酸铜;d—新制氢氧化铜悬浊液。
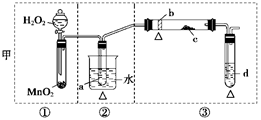
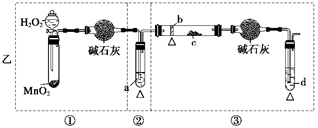
(1)简述两套方案各自的优点:
甲:__________________________________________________________________,
乙:___________________________________________________________________。
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_________________________________________________________(例如甲①,乙②)。
(3)若要保证此实验有较高的效率,还需补充的仪器有________,理由_______________。
(4)实验中能验证乙醇氧化产物的实验现象是________________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:__________________________________。
参考答案:(1)甲:①中用分液漏斗可以控制液体的流量,控制反应的进行;②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜、长导管起到冷凝回流乙醇蒸气的作用。(2分)
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证(2分)
(2)乙①,甲②,乙③(2分)
(3)温度计 控制水浴温度在78℃或略高于78℃,使乙醇蒸气平稳流出,减少挥发,提高反应效率。(2分)
(4)c处无水硫酸铜变蓝;d处生成红色沉淀(2分)
(5)C2H5OHCu△CH3CHO+H2↑(2分)
本题解析:(1)简述两套方案各自的优点:
甲:①中用分液漏斗可以控制液体的流量,控制反应的进行;②中用热水浴加热,可形成较平稳的乙醇气流,使反应更充分;②中的斜、长导管起到冷凝回流乙醇蒸气的作用。
乙:①与③中的干燥管可防止溶液中的水与无水硫酸铜反应,避免干扰生成物的验证
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为: 乙①,甲②,乙③
(3)若要保证此实验有较高的效率,还需补充的仪器有温度计, 理由是控制水浴温度在78℃或略高于78℃,使乙醇蒸气平稳流出,减少挥发,提高反应效率。
(4)实验中验证乙醇的氧化产物的实验现象是:c处无水硫酸铜变蓝;d处生成红色沉淀
(5) 则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式:
C2H5OHCu△CH3CHO+H2↑
本题难度:简单
5、实验题 (12分) 甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:氢氧化钠溶液滴入酚酞试液,溶液变成了红色,可是过了一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液浓度大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:?
?;
(2)丙同学认为乙同学的猜想也不正确,他的理由是?
?。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
实验步骤
| 设计这一步骤的目的
|
1.将配制的氢氧化钠溶液加热??
| ?
|
2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油?
| ?
|
(4)通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,大家能设计实验证明吗?
实验方法
| 可能观察到的现象和结论
|
方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。
| 物质的量浓度大的溶液中酚酞红色消失
证明?
|
方案二:向原红色消失的溶液中加?
(填试剂名称)
| 红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关
参考答案:⑴若酚酞变质,刚开始溶液就不会变红色了。
⑵氢氧化钠溶液与空气中的二氧化碳反应生成碳酸钠和水,碳酸钠水溶液显碱性,红色不会消失。
⑶①除去溶液的氧气?②利用植物油隔绝空气
⑷①红色消失与氢氧化钠的物质的量浓度大小有关?②水
本题解析:本题以实验探究为题材,考查学生的分析问题和解决问题的能力;(1)酚酞遇碱变红色,如果酚酞变质,则开始加入时就不能变成红色,故甲的说法不正确;(2)氢氧化钠与二氧化碳反应后生成碳酸钠溶液,碳酸钠溶液呈碱性,会使酚酞试液变红,故乙的说法也不正确;(3)丙同学先把氢氧化钠加热,是为了排净溶液中溶解的氧气,再加植物油是为了使试液与空气隔绝,防止发生氧化反应;(4)在丁同学的猜想中,如果在不同浓度的氢氧化钠溶液中,物质的量浓度大的溶液里酚酞的红色消失,则证明红色消失与氢氧化钠的物质的量浓度大小有关;若向红色消失的溶液中继续加水,红色重现,则证明其结论是正确的。
本题难度:简单
|