1、推断题 下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。

请填写以下空白:
(1)A的化学式_________B的电子式_____________。
(2)写出下列反应的化学方程式:
D+G→H________________________
F+J→B+C+I___________________________
(3)0.3mol I与足量C反应转移电子的物质的量为________mol
(4)容积为10mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为_____mL,_____mL。
参考答案:(1)NH4HCO3;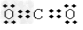
(2)4NH3+5O2 4NO+6H2O;C+4HNO3(浓)
4NO+6H2O;C+4HNO3(浓)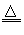 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(3)0.2
(4)82
本题解析:
本题难度:一般
2、填空题 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:______,B的电子式为:______,F的浓溶液与D在加热条件下反应的化学方程式为:______.
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是______.
(3)若A、D、F都是短周期非金属元素单质,且?A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是______,C是______,F是______.(填化学式)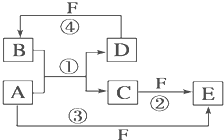
参考答案:(1)D为短周期非金属单质(一种黑色固体)可以推断为C,且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,则A为Mg,B为CO2,C为MgO,E为硝酸镁;化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,说明生成二氧化氮气体,则浓溶液F为浓硝酸;A在周期表中的位置:第三周期,ⅡA族;二氧化碳的电子式为::O::C::O:;F的浓溶液与D在加热条件下反应的化学方程式:C+4HNO3?加热?.?CO2↑+4NO2↑+2H2O,
故答案为:第三周期,ⅡA族;::O::C::O:;C+4HNO3?加热?.?CO2↑+4NO2↑+2H2O;
(2)若A是常见变价金属的单质,D、F是气态单质,反应①②均在水溶液中进行.说明A+B→C+D是置换反应,推断A为Fe,B为盐酸,D为氢气,C为氯化亚铁,F为Cl2;反应②的离子方程式是氯化亚铁和氯气发生的氧化还原反应,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,推断,B为SiO2,A为C,D为Si,C为CO,
E为CO2,F为O2;
故答案为:B、SiO2;C、CO;F、O2
本题解析:
本题难度:简单
3、填空题 如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如图转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体,试推断:
①X的电子式是______________?_,若丙为灰黑色固体,则其晶体类型为_________________(填分子晶体,原子晶体,混合型晶体)。
②工业上有些气体中也含有一定量的Z成分,试列举一种气体______________。
③X与甲反应的化学方程式_________________________?_。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙三种物质的化学式甲________?____、乙__________?__、丙________?____。
②写出X与足量的甲在溶液中完全反应的离子方程式:?。
参考答案:(1)① ,?混合型晶体
,?混合型晶体
②水煤气等? ③2Mg+CO2==2MgO+C
(2)①Cl2、? Fe、? Br2? ②3 Cl2+2 Fe2++4Br-="=2" Fe3++2Br2+6Cl-
本题解析:略
本题难度:简单
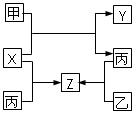
4、选择题 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)
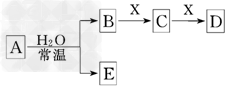
下列推断不正确的是
[? ]
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-===H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式为
D.若D为白色沉淀,与A的摩尔质量相等,则X一定是铝盐
参考答案:A
本题解析:
本题难度:一般
5、简答题 已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.
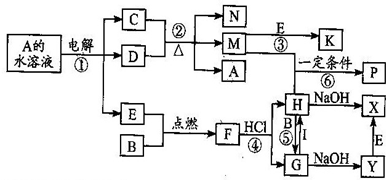
(1)B元素在周期表的位置:______,
(2)物质I的电子式:______.
(3)Y转变为X的现象是:______.涉及的反应方程式为:______.
(4)写出反应④的化学反应方程式:______.物质F与HI水溶液的离子反应方程式?式:______.
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质______.
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:______.
参考答案:A为硫酸盐,电解硫酸盐溶液,阳极上生成氧气E,阴极上析出金属单质C,说明金属单质C的活动性小于氢元素,且C为常见的金属单质,所以C是铜,则D是硫酸,A是硫酸铜;加热条件下,浓硫酸和铜反应生成硫酸铜、二氧化硫和水,水和硫酸铜都不与氧气反应,二氧化硫和氧气反应生成三氧化硫,所以M是二氧化硫,N是水,K是三氧化硫;B是金属,H和B反应生成G,G和I反应生成H,说明B是变价金属,且是常见金属,所以B是铁,铁和氧气反应生成四氧化三铁F,四氧化三铁和盐酸反应生成氯化铁和氯化亚铁,H和铁反应生成G,所以H是氯化铁,G是氯化亚铁,氯化亚铁和I反应生成氯化铁,则I是氯气,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,氯化亚铁和氢氧化钠反应生成氯化钠和氢氧化亚铁,Y和氧气能生成X,所以X是氢氧化铁,Y是氢氧化亚铁,二氧化硫和氯化铁溶液反应生成硫酸根离子、亚铁离子.
(1)铁在周期表中位于第四周期第ⅤⅢ族,故答案为:第四周期第ⅤⅢ族;
(2)氯气的电子式为:
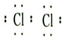
,故答案为:
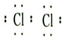
;
(3)氢氧化亚铁是白色沉淀,但不稳定,迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色絮状沉淀迅速变为灰绿色,最终转化为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应方程式为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,四氧化三铁和氢碘酸反应生成亚铁离子、碘单质和水,
离子方程式为Fe3O4+2I-+8H+=I2+3Fe2++4H2O,故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;Fe3O4+2I-+8H+=I2+3Fe2++4H2O;
(5)向沸水中加入H的饱和溶液,可制得氢氧化铁胶体,胶体的性质有:丁达尔效应、电泳、产生聚沉现象、不能透过半透膜,
A.氢氧化铁胶体具有丁达尔效应,故正确;
B.氢氧化铁胶粒带正电,加直流电源后,阴极附近溶液颜色加深,故错误;
C.加入盐酸溶液先出现聚沉现象,后盐酸和氢氧化铁反应生成氯化铁,所以出现的现象是先沉淀后溶解,故正确;
D.胶体粒子不能透过半透膜,能透过滤纸,故错误;
故选AC;
(5)向含1mol氯化亚铁溶液中加入1molNa2O2,根据得失电子数相等知,过氧化钠过量,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为Na2O2+H2O═2NaOH+12O2↑,氯化亚铁和氢氧化钠、氧气反应生成氢氧化铁和氯化钠,反应方程式为:2FeCl2+4NaOH+12O2+H2O═2Fe(OH)3↓+4NaCl,所以总的反应方程式为:4FeCl2+4Na2O2+6H2O═4Fe(OH)3↓+8NaCl+O2↑,离子方程式为:4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑,故答案为:4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑.
本题解析:
本题难度:一般