1、填空题 (16分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
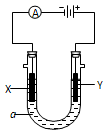
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是?,
在X极附近观察到的现象是?。
②Y电极上的电极反应?,
检验该电极反应产物的方法是?。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为_____
_________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。?
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是___________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
参考答案:(1)①2H+ + 2e—= H2↑ (2分)?有气泡产生,溶液变红色(1分)
②2Cl-—2e—= Cl2↑(2分)?用湿润的淀粉KI试纸(1分)
(2)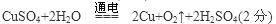 ? 0.4mol(2分)
? 0.4mol(2分)
(3)①精铜(1分),Cu2+ + 2e— =" Cu" (2分)
②粗铜(1分),Cu — 2e— = Cu2+(2分)
本题解析:(1)惰性电极电解饱和食盐水,阳极氯离子放电,生成氯气,电极反应式为2Cl-—2e—= Cl2↑。阴极水电离出的氢离子放电生成氢气,故阴极周围显碱性,电极反应式为2H+ + 2e—= H2↑。根据装置可判断,X是阴极,Y是阳极。氯气具有强氧化性,可以湿润的淀粉KI试纸检验。
(2)惰性电极电解CuSO4溶液时,阳极OH-放电,生成氧气,阴极铜离子放电析出单质铜,总的反应式为CuSO4+2H2O 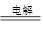 ?2Cu+O2↑+2H2SO4。16gCuO是0.2mol,这说明反应中析出了0.2mol铜,所以转移电子的物质的量是0.4mol。
?2Cu+O2↑+2H2SO4。16gCuO是0.2mol,这说明反应中析出了0.2mol铜,所以转移电子的物质的量是0.4mol。
(3)粗铜提纯时,粗铜应作阳极,精铜作阴极,硫酸铜溶液作电解液。Y是阳极,X是阴极,所以电极反应式分别为Cu — 2e— = Cu2+、Cu2+ + 2e— = Cu。
本题难度:一般
2、选择题 MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(l)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS +2H2SO4= MnSO4 +ZnSO4 +S↓+2H2O
(2)除去反应混合物中的不溶物
(3)电解混合液:MnSO4+ ZnSO4+2H2O MnO2+Zn+2H2SO4下列说法不正确的是
MnO2+Zn+2H2SO4下列说法不正确的是
[? ]
A.步骤(l)中MnO2和H2SO4都是氧化剂
B.步骤(1)中每析出12. 8 g S沉淀共转移0.8mol电子
C.步骤(3)中电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列各组的电极材料和电解质溶液中,不能组成原电池的是
A.铜片,石墨棒,稀硫酸
B.铜片,石墨棒,硝酸银溶液
C.锌片,铜片,稀盐酸
D.铜片,银片,FeCl3溶液
参考答案:A
本题解析:活泼性不同的电极,导线相连且插入电解质溶液中,才能构成原电池,据此可知选项BCD均可以构成原电池,A中铜与稀硫酸不反应,不能构成原电池,答案选A。
点评:该题是基础性试题的考查,试题难易适中,侧重对原电池原理和构成的考查。有助于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。
本题难度:简单
4、选择题 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是
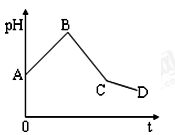
A.整个过程中阳极先产生Cl2,后产生O2
B.阳极产物一定是Cl2,阴极产物一定是Cu
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+