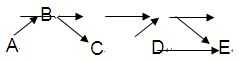
1、填空题 A、B、C、C、E是含有一种相同元素的五种物质,可发生如下转化关系:其中A是一种淡黄色粉末固体单质;B是气态氢化物;C、D是氧化物;E是该元素最高价氧化物对应的水化物。
(1)元素A在元素周期表中的位置为?。
(2)B的名称是?。
(3)写出C的一种用途?;
C的水溶液在空气中放置一段时间后溶液的pH减少,试说明其原因?
?。
(4)D溶于水发生反应的离子方程式?。
(5)E的浓溶液与碳单质反应的化学方程式?。
参考答案:(11分)(1) 第三周期第ⅥA族?(2分)(2)?硫化氢 ?
(3)漂白剂等、亚硫酸为弱酸,不稳定易被氧化为硫酸(强酸),所以pH值减小(各1分)?(4)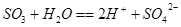 (3分)
(3分)
(5)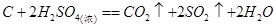 (3分)
(3分)
本题解析:A是一种淡黄色粉末固体单质,则A是S单质。B是气态氢化物,则B是H2S。C、D是氧化物,则C是SO2,D是三氧化硫。E是该元素最高价氧化物对应的水化物,所以E是硫酸。
(1)S位于周期表的第三周期第ⅥA族。
(2)B是硫化氢。
(3)SO2检验漂白性,所以可以用作漂白剂。亚硫酸检验还原性,易被空气氧化生成强酸硫酸,所以pH值减小。
(4)三氧化硫溶于水即生成硫酸。
(5)浓硫酸检验强氧化性,在加热的条件下,能把碳氧化生成CO2,而硫酸被还原生成SO2。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、填空题 (1)将m g铁粉和n g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入____Lb mol·L-1的盐酸就不再产生气体。若把已放出的气体收集起来,在标准状况下的体积是______。
 (2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L,其原因是__________________________________________________。
(2)若把0.1 mol铁粉和1.6 g硫粉均匀混合后,铺在石棉网上用酒精灯加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应,结果所产生的气体体积在标准状况下明显少于2.24 L,其原因是__________________________________________________。
参考答案:(1)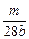 ? 0.4m L
? 0.4m L




 (2)与硫反应的铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成了铁的氧化物,与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L
(2)与硫反应的铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成了铁的氧化物,与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L
本题解析: (1)由Fe+S
(1)由Fe+S FeS,FeS+2HCl
FeS,FeS+2HCl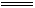 FeCl2+H2S↑,得Fe~2HCl;又由Fe+2HCl
FeCl2+H2S↑,得Fe~2HCl;又由Fe+2HCl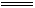 FeCl2+H2↑,得Fe~2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
FeCl2+H2↑,得Fe~2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
 设加入b mol·L-1盐酸的体积为V,则
设加入b mol·L-1盐酸的体积为V,则

 ×2=V×b mol·L-1,得V=
×2=V×b mol·L-1,得V=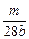 ?L或
?L或 ?mL
?mL
 标准状况下产生气体的体积为
标准状况下产生气体的体积为 ×22.4 L·mol-1=0.4m L。
×22.4 L·mol-1=0.4m L。

 (2)n(S)=
(2)n(S)=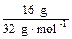 ="0.05" mol<0.1 mol,铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成的铁的氧化物与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L。
="0.05" mol<0.1 mol,铁粉过量,过量的铁粉在加热的条件下被空气中的氧气氧化,生成的铁的氧化物与H2SO4反应不再放出H2,故放出气体的体积小于2.24 L。
本题难度:一般
3、选择题 常温下,等物质的量SO2和H2S 气体,在一定容积的密闭容器中充分反应后,恢复到原温度,容器内压强变为原来的(?)
A.1/2
B.1/3
C.<1/4
D.>1/4
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列关于浓HNO3和浓H2SO4的叙述,正确的是
A.都不易分解
B.常温下都能与铜较快反应
C.露置在空气中,容器内溶液的质量都减小
D.露置在空气中,容器内溶液的浓度都减小
参考答案:D
本题解析:A、不正确,浓硝酸不稳定,易分解;4HNO3 2H2O+4NO2+O2;B、浓H2SO4在常温下与铜反应较慢;C、露置在空气中,容器内浓硝酸的质量减小,但浓硫酸具有吸水性,质量变大;D、正确,浓硝酸挥发,浓硫酸吸水,容器内溶液的浓度都减小。选D。
2H2O+4NO2+O2;B、浓H2SO4在常温下与铜反应较慢;C、露置在空气中,容器内浓硝酸的质量减小,但浓硫酸具有吸水性,质量变大;D、正确,浓硝酸挥发,浓硫酸吸水,容器内溶液的浓度都减小。选D。
本题难度:一般
5、选择题 将BaCl2溶液分别盛于两支试管中,第1支加入稀HNO3溶液,第2支加入烧碱溶液,然后再分别通入SO2气体,结果两试管均有白色沉淀产生。下列说法正确的是
A.证明SO2具有强氧化性和酸性
B.若第1支试管先通入Cl2,再通SO2气体,也有白色沉淀生成
C.若第2支试管先通入NH3,再通SO2,不会产生沉淀
D.若第1支试管中先加入稀HNO3溶液,再加入Na2SO3溶液,则无沉淀生成
参考答案:B
本题解析:首先明确SO2g与BaCl2不能反应,因为弱酸不能制取强酸,但:
第1试管:SO2被硝酸氧化为硫酸,遇BaCl2溶液生成硫酸钡沉淀
第2试管:SO2与碱生成亚硫酸盐,遇BaCl2而生成亚硫酸钡白色沉淀
分别体现了SO2的还原性及酸性氧化物的性质。
同样道理,其中的硝酸可用氯气代替,碱液可用氨水代替,SO2可用Na2SO3溶液代替。
本题难度:一般