SO2有酸性,没有漂白性
参考答案:B
本题解析:A.证明SO2有还原性,错误;B.使品红溶液褪色是SO2有漂白性,正确;C. SO2与NaOH溶液发生反应,由于产物容易溶于水,也没有明显 的颜色变化等,所以无明显现象,错误;D. SO2使紫色石蕊试液变红色后不褪色,是因为SO2与水反应产生了酸有酸性,但是其只能使某些有色物质褪色,而不是使所有有色物质褪色,错误。2的性质及检验的知识。
本题难度:一般
3、填空题 硫酸工业生产应考虑综合经济效益问题。
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+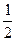 O2(g) O2(g) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为?。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
沸腾炉温度/℃
| 600
| 620
| 640
| 660
| 矿渣中CuSO4的质量分数/%
| 9.3
| 9.2
| 9.0
| 8.4
|
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因?。
参考答案:(1)6.23×105 kJ的热量
(2)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2 4CuO+2Fe2O3+8SO2
(3)SO2转化为SO3是正反应放热的可逆反应,随温度的升高,平衡向逆反应方向移动,SO3的物质的量减少,所以CuSO4的量减少
本题解析:(1)SO2~SO3~H2SO4?放出的热量
98 g? 98.3 kJ
1×106×98% g?x
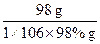 = =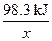
x=9.83×105 kJ
9.83×105 kJ-3.6×105 kJ=6.23×105 kJ
所以可向外界输出6.23×105 kJ的热量
(2)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2 4CuO+2Fe2O3+8SO2
(3)SO2转化为SO3是正反应放热的可逆反应,随温度的升高,平衡向逆反应方向移动,SO3的物质的量减少,所以CuSO4的量减少
本题难度:简单
4、选择题 关于硫和氧的性质叙述正确的是
A.硫在O2中燃烧生成SO2
B.硫在O2中燃烧生成SO3
C.硫的非金属性比氧的强
D.氧的非金属性比硫的强
参考答案:AD
本题解析:硫燃烧的生成物是SO2,A正确,B不正确。硫和氧属于第ⅥA主族,非金属性是O大于S,C不正确,D正确。答案选AD。
本题难度:一般
5、选择题 世界年产量95%以上的H2O2由蒽醌氧化法生产。反应过程如下:


下列说法不正确的是(?)
A.H2O2可用作漂白剂、消毒剂,也可作为火箭燃料
B.H2O2可使湿润的KI淀粉试纸变蓝
C.蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2
D.H2O2化学性质稳定,便于储存和运输
参考答案:D
本题解析:H2O2化学性质不稳定,受热后易分解,因此D项错误。H2O2具有强氧化性,A、B项正确;将题目中①②两式合并分析可得知C项正确。
本题难度:简单
|