1、选择题 二氧化硫能使浸过溴水的滤纸褪色,这说明了
A.二氧化硫的漂白性
B.溴的挥发性
C.溴的氧化性
D.二氧化硫的氧化性
2、选择题 如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )

选项
| 试剂
| 现象
| 结?论
|
A
| 酸性KMnO4溶液
| 溶液褪色
| SO2有氧化性
|
B
| 品红溶液
| 溶液褪色
| SO2有漂白性
|
C
| NaOH溶液
| 无明显现象
| SO2与NaOH
溶液不反应
|
D
| 紫色石蕊试液
| 溶液变红色后不褪色
| SO2有酸性,没有漂白性
3、填空题 硫酸工业生产应考虑综合经济效益问题。
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+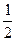 O2(g) O2(g) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1) SO3;ΔH="-98.3" kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为?。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
沸腾炉温度/℃
| 600
| 620
| 640
| 660
| 矿渣中CuSO4的质量分数/%
| 9.3
| 9.2
| 9.0
| 8.4
|
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因?。
4、选择题 关于硫和氧的性质叙述正确的是
A.硫在O2中燃烧生成SO2
B.硫在O2中燃烧生成SO3
C.硫的非金属性比氧的强
D.氧的非金属性比硫的强
5、选择题 世界年产量95%以上的H2O2由蒽醌氧化法生产。反应过程如下:


下列说法不正确的是(?)
A.H2O2可用作漂白剂、消毒剂,也可作为火箭燃料
B.H2O2可使湿润的KI淀粉试纸变蓝
C.蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2
D.H2O2化学性质稳定,便于储存和运输
|