1、计算题 硫酸是化学工业中的重要原料,至2010年我国已成为全球硫酸产能最高、产量最大的国家。
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气。当浓硫酸浓度降到16 mol/L(密度1.8g/cm3)以下时,则失去干燥能力。
①16 mol/L的硫酸的质量分数为?(保留两位小数,下同)。
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水?g。
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 9.920 g,与足量稀硫酸反应,收集到气体2.688 L(换算到标准状况),质量为3.440 g。则固体M的成分为
?(写化学式),其中铁元素与硫元素的质量比为?。
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20)。
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为?。
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为?%。
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐。为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果如下:
铵盐质量为10.000 g和20.000 g时,浓硫酸增加的质量相同;
铵盐质量为30.000 g时,浓硫酸质量增重0.680 g;
铵盐质量为40.000 g时,浓硫酸的质量不变。
①计算该混合盐中氮元素的质量分数。
②计算上述氢氧化钠溶液的物质的量浓度。
参考答案:(1)(4分)① 0.87;②11.63;(每小题2分)
(2)(3分)FeS、Fe(1分),21:10;(2 分)
(3)(4分)① 0.11;② 92.5%;(每小题2分)
(4)(5分)
①设:NaOH为amol,NH4HSO4为xmol, (NH4)2SO4为ymol。
则有:

解得:a=0.232
x=0.064
y=0.02
 (3分)
(3分)
② ?(2分)
?(2分)
本题解析:
(1)(4分)①
②由溶质质量守恒
50ml×1.84g/ml×0.98=16mol/l×(50ml×1.84g/ml+mg)/1.8g/ml×98g·mol-1
m=11.63g
(2)(3分)FeS、Fe(1分),21:10;(2 分)
Fe+S FeS
FeS
FeS+H2SO4=FeSO4+H2S↑
Fe+H2SO4=FeSO4+H2↑,
n(气)= 2.688 L/22.4l·mol-1=0.12mol
n(H2S)+n(H2)=0.12mol
n(H2S)×34g·mol-1+n(H2)×2 g·mol-1= 3.440 g
n(H2S)=n(FeS)=0.1mol,n(H2)=0.02mol,
m(Fe):m(S)=(9.920g-0.1mol×32g·mol-1):( 0.1mol×32g·mol-1)=21:10
(3)(4分)① 0.11;② 92.5%;(每小题2分)
①4FeS2+11O2 2Fe2O3+8SO2,
2Fe2O3+8SO2,
通入过量40%的空气,则煅烧后炉气中SO2的体积分数为
?8÷(11×4+11×40%×5+8)×100%=8÷74×100?%=11%
② ?2 SO2?+? O2 ?2SO3? △V
?2SO3? △V
2? 1? 1
0.1m3/s? 0.05m3/s? 1.00m3/s―0.95m3/s
SO2的总体积:1.00m3/s×8÷74×100?%="0.108" m3/s,
SO2的转化率为0.1m3/s÷0.108 m3/s×100%=92.5%
(4)(5分)
①设:NaOH为amol,NH4HSO4为xmol, (NH4)2SO4为ymol。
则有:

解得:a=0.232
x=0.064
y=0.02
 (3分)
(3分)
② ?(2分)
?(2分)
本题难度:简单
2、选择题 下列材料最不适宜储运浓硫酸、浓硝酸的是
A.铁
B.铜
C.陶瓷
D.铝
参考答案:B
本题解析:浓硫酸、浓硝酸均具有强氧化性,但常温下铁、铝和浓硫酸、浓硝酸会发生钝化,因此可以铁制容器或铝制容器来储运浓硫酸、浓硝酸;陶瓷属于无机非金属材料,主要成分是二氧化硅,二氧化硅性质稳定不溶于浓硫酸、浓硝酸,因此页可以用来储运浓硫酸、浓硝酸;铜和浓硫酸需要加热才能发生氧化还原反应,和浓硝酸在常温下即可被氧化,因此铜制容器不能用来储运浓硫酸、浓硝酸。
本题难度:简单
3、填空题 (13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
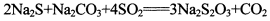 o
o
(1)?在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2)?用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
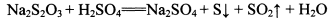
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水

(3)?已知: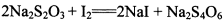 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用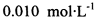 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
参考答案:(1)赶走水中的溶解氧(或空气)?(2分)
(2)晶体中含Na2S和Na2CO3两种杂质(2分)
不合理;(1分)? Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出。(2分)
实验方案
现象及结论
取适量晶体于烧瓶中,加入足量3 mol?L-1 H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有酸性KMnO4溶液、品红溶液、澄清石灰水的洗气瓶。(2分)
品红溶液不褪色、澄清石灰水变浑浊,晶体中含Na2CO3杂质(2分)
?(其他合理答案均给分)
(3)晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水(2分)(其他合理答案均给分)
本题解析:晶体的主体Na2S2O3·5H2O与稀H2SO4反应生成的SO2对H2S和CO2的检验都有干扰,在检验时应充分考虑;考虑到晶体中含有的杂质(Na2S)在滴定时参与反应,是解答第(3)小题的关键。
本题难度:一般
4、选择题 将0.2mol铁与一定质量的硫粉混合加热后的混合物再加足量的盐酸,收集到的气体在标准状况下为(不考虑气体的溶解)(? )
A.1.12L
B.3.36L
C.4.48L
D.7.48L
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列关于SO2的说法中,不正确的是
A.SO2是硫及某些含硫化合物在空气中燃烧的产物
B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4
D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧
参考答案:C
本题解析:
答案:C
C.不正确,SO2与水反应生成H2SO3;
硫及某些含硫化合物,化石燃料的燃烧,都产生SO2,是大气污染物,是酸性氧化物,能与水、碱、部分氧化剂、还原剂反应,具有漂白性,可以使品红溶液褪色。A、D、B均正确。
本题难度:一般