1、选择题 向氯酸钠的酸性水溶液中通入SO2,反应中氧化过程为:SO2+2H2O—2e-→SO42-+4H+;
向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2+2e- →2Cl-。在上述两个反应中均会生成产物X,则X可能是
A.ClO2
B.NaClO4
C.HClO
D.NaClO
2、实验题 某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性。
请写出Ca在空气中燃烧发生反应的化学方程式:?。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式:?。
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2)。臭氧还原为氧气。反应式为:O3+2KI+H2O=O2+I2+2KOH 【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有?;
假设3:该臭味气体含有?。
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验。请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选)。
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水。设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论。
实验操作
| 预期现象和结论
|
取少量反应后固体于试管中,?
?
?
?。
| ?
|
?
3、选择题 有Fe2+、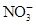 、Fe3+、
、Fe3+、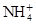 、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(? )
、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是(? )
A.氧化剂与还原剂的物质的量之比为8∶1
B.还原产物为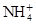
C.若有1 mol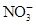 参加还原反应,转移8 mol e-
参加还原反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
4、填空题 (1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+ +H2SO4—→ + + + +H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则①Br2的化学计量数是 ;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
KBrO3+ + H2SO4—→……;
③若转移10 mol电子,则反应后生成I2的物质的量为 。
5、选择题 一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L,?测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
A.反应后溶液中无硝酸亚铁
B.反应前HNO3溶液的浓度为2.0mol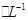
C.反应后溶液中c(NO3-)=1.6mol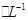
D.反应后的溶液最多还能溶解1.6lgFe