1、简答题 氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
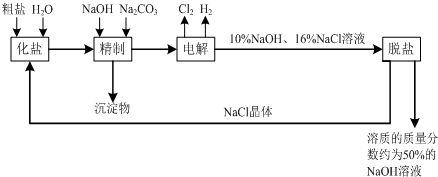
依据上图,完成下列问题:
(1)写出电解饱和食盐水的离子方程式:______.
(2)粗盐常含Ca2+、Mg2+、SO42-等杂离子,精制过程中要将它们以沉淀的形式除去,则加入试剂的合理顺序为______(填编号).
A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液
B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3
C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______(填写操作名称)、冷却结晶、______(填写操作名称),除去NaCl.
(4)由图示可知在电解制碱过程中______可以循环使用,以提高反应物利用率;在制碱的同时,还产生H2和Cl2,工业上常常利用它们生产______.
(5)如图所示,目前电解法制烧碱通常采用离子交换膜法,阳离子交换膜不允许阴离子通过,阴离子交换膜不允许阳离子通过.

则以下叙述正确的是______(填编号).
A.NaOH、H2均在Ⅰ区产生
B.图中a为阴离子交换膜,b为阳离子交换膜
C.Ⅲ区炭棒上的电极反应式为?2Cl--2e→Cl2↑
D.取少量Ⅲ区中的溶液,滴加酚酞,溶液变红色
(6)在实际生产中,经过脱盐后得到含溶质质量分数约为50%的NaOH溶液(密度为1.92g/cm3),则该烧碱溶液的物质的量浓度为______.
参考答案:(1)电解氯化钠溶液的生成物是氢氧化钠、氯气和氢气,即:2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O ?电解?.?Cl2↑+H2↑+2OH-;
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入Na2CO3的顺序必须在加入钡离子的后面即可,分析四个选项可知BC符合题意.
故答案为:BC;
(3)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂结晶的方法,除去氢氧化钠中的氯化钠,故答案为:蒸发浓缩;过滤;
(4)根据循环图,可以循环使用的物质是氯化钠,工业上可以用氯气和氢气反应生成氯化氢来生产盐酸,故答案为:NaCl;盐酸;
(5)A、根据电解的工作原理:阳极放电的是氯离子,生成氯气,阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,故A正确;
B、图中Ⅰ区产生了氢氧化钠,是氢离子放电的电极区域,钠离子可以通过a,所以a为阳离子交换膜,b为阴离子交换膜,故B错误;
C、Ⅲ区炭棒是阳极,该极上的电极反应式为?2Cl--2e→Cl2↑,故C正确;
D、Ⅲ区中生成的是氯气,和水反应生成盐酸和次氯酸,溶液显酸性,该溶液滴加酚酞,溶液无色,故D错误.
故选AC;
(6)质量分数和物质的量浓度间的关系c=1000ρw%M,所以该烧碱溶液的物质的量浓度C=1000×1.92g/ml×50%40g/mol=24.0mol/L.
故答案为:24.0mol/L.
本题解析:
本题难度:一般
2、填空题 (12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
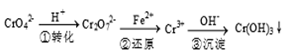
其中第①步存在下列平衡:2CrO42- (黄色) +2H+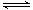 Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s) 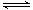 Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
参考答案:(1)橙色;(2) C;(3) 5;(4) 提供Fe2+作还原剂;(5) 2H++2e-=H2↑;Fe(OH)3
本题解析:(1)根据平衡移动原理:若平衡体系的pH=2,该溶液显强酸性,在酸性环境,平衡正向移动,因此溶液呈橙色;(2)A.Cr2O72-和CrO42-的浓度相同,溶液可能处于平衡状态,也可能处于非平衡状态,错误;B.在任何状态,都存在:V(Cr2O72-):V(CrO42-)=1:2;即V(CrO42-)=2V(Cr2O72-),因此不能说明该反应处于平衡状态,错误;C.若反应未达到平衡状态,则溶液的颜色会发生改变,因此溶液的颜色不变能说明第①步反应达平衡状态,正确;(3)Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32,由于c(Cr3+)= 10-5mol/L,所以c3(OH-)=10-32÷10-5=10-27。c (OH-)=10-9;由于在溶液中存在水的电离平衡,c(H+)=10-5 mol/L。所以溶液的pH=5;该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。(4)用Fe做电极的原因为Fe作阳极发生氧化反应:Fe-2e-=Fe2+;Cr2O72-与Fe2+会发生氧化还原反应产生Cr3+;(5)溶液中的阳离子的放电能力:H+>Fe3+;在阴极上H+得到电子发生反应:2H++2e-=H2↑;使溶液中c(OH-)增大,所以阴极附近溶液pH升高;Fe3++3OH-= Fe(OH)3↓,所以溶液中同时生成的沉淀还有Fe(OH)3。
考点:考查化学平衡移动、反应平衡状态的判断、沉淀溶解平衡的应用、电解原理在污水处理的应用。
本题难度:困难
3、选择题 下列有关说法正确的是 ( )
A.汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的ΔH>0
B.纯碱溶于热水中,去油污效果增强,说明纯碱的水解是放热反应
C.为保护海轮的船壳,常在船壳上镶入锌块
D.以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动