1、选择题 下列变化中,由加成反应引起的是
A.将乙醇蒸汽通过 灼热的氧
灼热的氧 化铜,固体颜色由黑色变为红色
化铜,固体颜色由黑色变为红色
B.苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷
C.一定条件下,将苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成
D.往溴水中加入四氯化碳溶液,水层褪色
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (13分).Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)

①连接仪器、?、加药品后,打开a,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是:
?。
③从品红溶液中观察到的现象说明SO2具有?性。?
④高锰酸钾溶液中的实验现象是?。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式?
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
编号
| 实验操作
| 预期现象和结论
|
步骤①
| ?
| 有白色沉淀生成,证明待测液中含SO42-。
|
步骤②
| ?
| ?
|
步骤③
| ?
| ?
|
……
| ?
| ?
参考答案:(共13分)Ⅰ、①检验装置气密性(1分)
② Cu + 2H2SO4(浓) ?△?CuSO4 + SO2↑+ 2H2O(2分)
③漂白性(1分)
④溶液由紫红色变为无色(1分)
Ⅱ、(1)? SO32- + Br2 + 2 OH-? =? H2O? + SO42- + 2Br-?(2分)
(6分)
编号
实验操作
预期现象和结论
步骤①
取少量待测液加入试管中,加入过量的2 mol·L-1盐酸,再滴加适量l mol·L-1BaCl2溶液。(2分)
?
步骤②
方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色。(2分)(若再加入四氯化碳,振荡,静置后观察颜色也可)
溶液呈橙黄色,证明待测液中含Br-。(2分)
(下层液体呈橙红色,证明待测液中含Br-。)
方法2:另取少量待测液加入试管中,加入足量的2 mol·L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色。(2分)(若再加入四氯化碳,振荡,静置后观察颜色也可)
溶液呈橙黄色,证明待测液中含Br-。(2分)
(下层液体呈橙红色,证明待测液中含Br-。)
本题解析:考查SO2气体的制取及性质、离子的检验
Ⅰ、①装置连接好后,必须检验装置的气密性
②Cu + 2H2SO4(浓) ?CuSO4 + SO2↑+ 2H2O ?CuSO4 + SO2↑+ 2H2O
③SO2可与某些有色物质形成不稳定的无色物质,使其褪色,表现为漂白性
④SO2还原性较强,可还原高锰酸钾溶液,使其由紫色转变为无色
Ⅱ、(1)碱性情况下,Br2氧化Na2SO3为Na2SO4,而Br2被还原为Br-,故反应的离子为:SO32- + Br2 + OH-? =? H2O? + SO42- + Br-,再根据化合价的升降守恒可得:SO32- + Br2 + OH-? =? H2O? + SO42- + 2Br-,最后结合电荷守恒及原子守恒可配平为:SO32- + Br2 + 2 OH-? =? H2O? + SO42- + 2Br-
(2)为了防止其它离子的干扰,SO42-的检验必须为:取少量待测液,加入过量的盐酸,再滴加适量BaCl2溶液,如若有白色沉淀生成,则证明SO42-的存在
而Br-的检验,一般是通过采用加入氧化剂,将其氧化为溴单质,根据溴水的颜色可溴在有机溶剂中的颜色来判定,但为防止同样有强还原性的SO32-离子的干扰,首先也需要加酸将其除去,故
方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色。(若再加入四氯化碳,振荡,静置后观察颜色也可)
方法2:另取少量待测液加入试管中,加入足量的盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色。(若再加入四氯化碳,振荡,静置后观察颜色也可)
本题难度:简单
3、实验题 已知1,2-二氯乙烷常温下为无色液体,沸点为83.5 ℃,密度为1.23 g·mL-1,难溶于水,易溶于醇、醚、丙酮等有机溶剂。乙醇的沸点为78.5 ℃。某化学课外活动小组为探究1,2-二氯乙烷的消去反应,设计了如图所示的实验装置(加热装置略去)。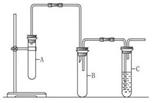
(1)如图所示,连接好仪器装置之后,首先需进行的操作是?。
(2) 向装置A中大试管中加入1,2二氯乙烷和??(写名称);并向装置C中试管里加入适量溴水。A中发生反应的化学方程式是 ??。
(3)与装置A中大试管相连接的长玻璃管除导气外的作用是 __________________,装置B的作用是 _________________。
(4)证明1,2 -二氯乙烷已发生消去反应的现象是_______________,还可通过什 -二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。 么实验加以验证:________________________________________。
参考答案:(1)检查装置的气密 性?(2)氢氧化钠的乙醇溶液(或“碱的醇溶液”) 性?(2)氢氧化钠的乙醇溶液(或“碱的醇溶液”)
ClCH2CH2Cl+2NaOH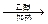 CH≡CH↑+2NaCl+2H2O CH≡CH↑+2NaCl+2H2O
(或ClCH2CH2Cl+NaOH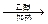 CH2=CHCl↑+NaCl+H2O) CH2=CHCl↑+NaCl+H2O)
(3) 冷凝回流?防止倒吸
(4) 溴水褪色?取反应后的混合液少许,向其中滴加稀硝酸呈酸性,再滴加AgNO3溶液,若有白色沉淀生成,则证明1,2-二氯乙烷发生了消去反应(要点1:滴加稀硝酸呈酸性;要点2:滴加AgNO3溶液,有白色沉淀生成)
本题解析:略
本题难度:简单
4、实验题 (14分)某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。

(1)装置D中试管口放置的棉花中应浸一种液体,这种液体是?,其作用是?。
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是?。B中应放置的液体是?(填字母)。
a.水 b.酸性KMnO4?c.浓溴水? d.饱和NaHSO3
(3)取6.4g铜片和12mL 18.4mol·L-1浓硫酸放在圆底烧瓶中共热, 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是?
②下列药品能用来证明反应结束后烧瓶中确实有余酸的是?(填字母)。
a.铁粉? b.银粉? c.碳酸氢钠溶液? d.氯化钡溶液
(4)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片和浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的是
?(填字母)
a.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
b.将装置中产生的气体缓缓通入足量氢氧化钡溶液中,反应完全后过滤、洗涤、干燥、称量沉淀
c.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液中,反应完全后过滤,洗涤干燥、称量沉淀
参考答案:

本题解析:略
本题难度:简单
5、实验题 某校三个研究性学习小组对“葡萄糖溶液与新制的氢氧化铜悬浊液作用得到的砖红色沉淀是Cu2O”提出质疑。
(1)甲小组认为红色沉淀不一定是Cu2O,为此展开了确定红色沉淀成分的研究。
步骤一:提出假设::?。
步骤二:查阅资料。得出:① +1价的铜在酸性条件下易发生自身氧化还原反应;
② 在空气中灼烧氧化亚铜生成氧化铜。
步骤三:设计方案、实验。
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却,
再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色
|
沉淀析出。
你认为合理的方案是(填字母)?。
(2)乙小组针对甲小组的假设,另设计如如下图装置进行验证。
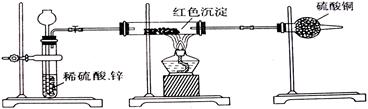
若按乙组装置定性检验上述红色沉淀成分,可根据?现象的发生与否即可判断。
若按乙组装置定量测定上述红色沉淀的成分,你认为理论上应该测定下列哪些物理量?(填序号)。
①通入氢气的体积;②反应前红色沉淀和硬质玻管的总质量;③完全反应后红色固体和硬质玻璃管的总质量;④实验前干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后干燥管质量
该实验装置中距实际可行性方面存在的缺陷有?
?(请写出两点)。
参考答案:(1)假设①:红色沉淀成分为Cu;假设②:红色沉淀成分为Cu2O;假设③:红色沉淀成分为Cu和Cu2O。(答出任一假设得2分)? C?(2分)
(2)硬质玻管有水或干燥管内白色粉末变蓝(2分)②③⑤(3分,错或漏一个扣1分,错或漏2个0分) 从发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿堤氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收等考虑(答出1点给1分,答出2点给3分)
本题解析:
(1)?由于Cu、Cu2O都为红色,所以将产生三种可能:Cu、Cu与Cu2O、Cu2O
A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化,该方法最终固体都将全部溶解,溶液变成兰色。
B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣,以上三种可能不管那一种用该方法最终都会有残渣
D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色沉淀析出。以上三种可能不管那一种用该方法都会产生Cu,最终都会置换出银。
(2)?氢气如果还原Cu2O则有水生成,硬质玻管有水或干燥管内白色粉末变蓝
只要有②③⑤就可以用差量法和极值法计算出结果
?从发生装置产生的氢气中含有水、硬质玻管内水分很难全部被潮湿的氢气赶尽、外界空气中的水蒸气也会被无水硫酸铜吸收等考虑
本题难度:一般