1、简答题 CO2可溶于水生成碳酸.有人为确认H2CO3、CH3COOH和
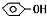
的酸性强弱,设计了如图装置,一次实验即可达到目的,请依据此实验填空:
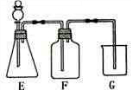
①锥形瓶内装某可溶性正盐固体,分液漏斗中所盛试剂名称是______;
②装置F中所盛的试剂是______,装置F所盛试剂的作用是______;
③装置G中发生反应的化学方程式是______.
参考答案:①根据强酸制取弱酸的原则,分液漏斗中应盛放最强的酸,最强的酸是醋酸,所以分液漏斗中所盛试剂名称是醋酸,故答案为:醋酸;
②醋酸有挥发性,导致二氧化碳气体中含有醋酸,会对实验造成干扰,所以F装置要盛放能除去醋酸,且不引起二氧化碳产生新的杂质、不能和二氧化碳反应的药品,一般常用碳酸氢钠溶液;该试剂的作用是除去二氧化碳中的醋酸杂质,
故答案为:饱和碳酸氢钠溶液;除去二氧化碳中的醋酸杂质;
③苯酚钠能和二氧化碳、水反应生成苯酚和碳酸氢钠,反应方程式为
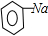
+CO2+H2O→
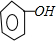
+NaHCO3,
故答案为:
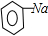
+CO2+H2O→

+NaHCO3.
本题解析:
本题难度:一般
2、选择题 下列关于化学学习和研究的说法错误的是
[? ]
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量试验事实的总结
C.化学家提出的假设都能被试验证明
D.化学基本原理的应用是有一定条件的
参考答案:C
本题解析:
本题难度:简单
3、选择题 从下列事实所列出的相应结论正确的是( ? ) ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?
?
| 实?验?事?实
| 结?论
|
A
| Cl2的水溶液可以导电
| Cl2是电解质
|
B
| SO2通入硝酸钡溶液出现白色沉淀
| BaSO3不溶于强酸
|
C
| NaHCO3溶液与NaAlO2溶液混合产生白色沉淀
| 酸性:HCO3->Al(OH)3
|
D
| SO2通入KMnO4溶液,溶液褪色
| SO2具有漂白性
参考答案:C
本题解析:
本题难度:简单
4、选择题 1995年三位美国科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,由图可知( )
A.日光在反应中做催化剂
B.过氧化氯是一种很稳定的物质
C.过氧化氯的结构式为O-Cl-Cl-O
D.臭氧分子最终转变为氧气分子
|
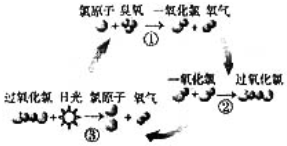
参考答案:D
本题解析:
本题难度:一般
5、实验题 化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中置一些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
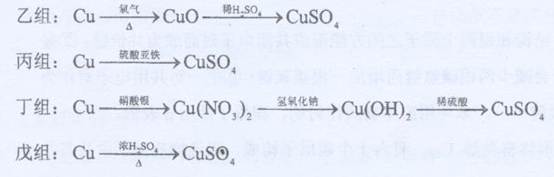
(1)甲组实验可用一个化学反应方程式表示为?,使反应变快的可能原因是?。
(2)在五个方案中,科学性有错的是?组方案,经济性最差的是?组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用?组方案;②无污染,这应排除?组方案。
(4)相对能耗低,污染小的是?组方案。该给从反应器中排出的溶液中(含有少量H2SO?4?以抑制水解)取得产品的实验操作步骤应为?、?、?,对取得产品后残留物质的处理方法是?。
参考答案:
(1)2Cu+O2+2H2SO4→2CuSO4+2H2O,形成了原电池
(2)丙,丁,
(3)乙戊,戊
(4)甲,加热蒸发、冷却结晶、过滤并洗涤晶体,循环使用。
本题解析:
本题考查实验探究。(1)通入的氧气作为氧化剂,在溶液中置一些铂丝,与铜形成原电池,反应速率加快;(2)铜与Fe2+不反应,丙方案错误;丁方案所需要的原料很多,反应步骤太多,且费用很大,经济效益很差;(3)要求能耗尽量低,则必须在常温下进行,乙戊排除;要求无污染,排除戊,戊方案可以产生SO2;(4)甲方案不需加热,且没有污染性气体产生为最佳方案。
本题难度:一般