1、填空题 要制取H2、O2、Cl2、HCl、NH3、H2S,从下列各物质中,分别选出必要的物质,将序号填在括号内。
a.硫化亚铁? b.浓硫酸? c.浓盐酸? d.二氧化锰
e.硝酸钠? f.铜片? g.氯化铵? h.锌? i.浓硝酸
j.氢氧化钙? k.稀硫酸? l.食盐晶体? m.氯酸钾
n.稀硝酸? o.高锰酸钾
制H2______________,制O2______________,制Cl2______________,制HCl______________,
制NH3_____________,制H2S______________。
上述气体中最不适于用排水法收集的是______________;最不适于用浓硫酸干燥的是______________;最适于用向上排气取气法收集的是______________。
参考答案:h和k? d与m或o? c与d? b与l? g与j? a与k
HCl、NH3? H2S、NH3? Cl2、HCl、H2S
本题解析:如果能熟记各种气体的性质,有利于对所制取气体的药品的选择。比如NH3极易溶于水,所以要选择固态物质来制取;H2S有还原性,所以它不能用氧化性很强的物质如浓硫酸、浓或稀硝酸来制取,而H2S又是一种弱酸,所以要选择强酸来制取;Cl2有氧化性,所以只好用氧化其阴离子的方法来制取,因此要选择含Cl-的物质和具有氧化性的物质来制取。根据这样一些原则,某种气体往往不止是一种制法,我们只要求掌握课本上用过的方法就可以了。
掌握气体的收集和干燥方法,关键也在识记好气体的物理、化学性质。易溶于水的气体,不能用排水集气法收集,比如NH3、HCl、H2S;比空气轻的气体只能用向下排气集气法收集,比如H2、NH3;具有还原性的气体,不能用具有氧化性的物质来干燥,具有碱性的气体不能用具有酸性的物质来干燥。
本题难度:简单
2、选择题 使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是(?)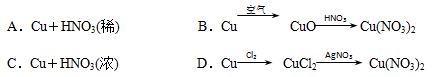
参考答案:B
本题解析:A、B、C、D发生的反应分别为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2Cu+O2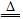 2CuO、CuO+2HNO3=Cu(NO3)2+H2O;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu+Cl2
2CuO、CuO+2HNO3=Cu(NO3)2+H2O;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;Cu+Cl2 CuCl2、CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2。生成等物质的量的硝酸铜消耗硝酸最少的是方案B,而且B方案无污染。D方案需使用氯气,氯气是有毒气体而且硝酸银价格昂贵,不经济。
CuCl2、CuCl2+2AgNO3=2AgCl↓+Cu(NO3)2。生成等物质的量的硝酸铜消耗硝酸最少的是方案B,而且B方案无污染。D方案需使用氯气,氯气是有毒气体而且硝酸银价格昂贵,不经济。
点评:评价化学实验方案的优劣一般考虑:有无污染、消耗原料多少、原料来源是否广泛、原料是否廉价等。
本题难度:一般
3、选择题 用喷泉实验装置且烧杯溶液用NaOH溶液代替,不能进行喷泉实验的气体是(?)
A.HCl和CO2
B.NH3和HBr
C.SO2和CO
D.SO2和NO2
参考答案:C
本题解析:喷泉实验成功的关键是产生较大的压强差。常见的是极易溶于水的气体或易于反应的气体。
本题难度:简单
4、填空题 (7分)NO2溶于水生成HNO3和NO,工业上利用这一反应原理制取HNO3 。
3NO2+H2O=2HNO3+NO?(第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2,工业上通常把生成的NO再次氧化为NO2,再次用水吸收
2NO+O2=2NO2?(第一次通O2)
3NO2+H2O=2HNO3+NO?(第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2,如果按上述方法进行循环氧化吸收:
(1)则第二次吸收后,NO2的总吸收百分率为?(可以用分数表示,下同),第二次通入O2的体积为?升,第三次吸收后还剩余NO?升。
(2)第n次吸收后剩余NO的体积为?升(用含n的代数式表示)。
(3)如果要使3升N O2恰好完全转化为HNO3,则需通入O2的总体积为?升。
O2恰好完全转化为HNO3,则需通入O2的总体积为?升。
(所有气 体体积均在相同条件下测定)
体体积均在相同条件下测定)
参考答案:(10分)(1)8/9,? 1/6?,? 1/9?。?(2)? 1/(3n-1)。?(3)3/4。
本题解析:略
本题难度:一般
5、选择题 Na3N是离子化合物,它与水作用可产生NH3,下列叙述正确的是( )
①Na3N与盐酸反应后生成两种盐
②在Na3N与水的反应中,Na3N作还原剂
③Na+与N3-的电子层结构都与氖原子相同
④Na+的半径大于N3-的半径
A.①②
B.③④
C.①③
D.②④
参考答案:C
本题解析:解析:Na3N与水反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑,产物与盐酸反应时生成NaCl和NH4Cl两种盐,该反应为非氧化还原反应。Na+和N3-具有相同的电子层结构,离子半径Na+<N3-。
本题难度:简单