1、填空题 (10分)
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
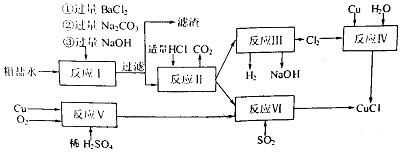
(1)反应I中加Na2CO3溶液的作用是?。
过一步反(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为?。
(3)写出反应VI的化学方程式?。
(4)反应IV加入的Cu必须过量,其目的是?。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是?。
参考答案:(1)除去Ca2+和过量的Ba2+
(2)2Cl—2e-=Cl2↑
(3)2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+2NaHSO4+H2SO4
或2CuSO4+2NaCl+SO2+2H2O=2CuCl↓+Na2SO4+2H2SO4
(4)防止生成CuCl2
(5)加快乙醇和水的蒸发,防止CuCl被空气氧化
本题解析:略
本题难度:一般
2、选择题 符合如下实验过程和现象的试剂组是( )
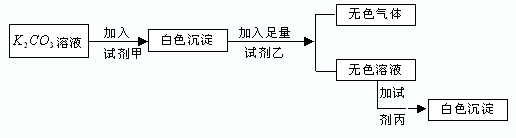
| 甲 | 乙 | 丙
A.MgCl2
HNO3
K2SO4
B.BaCl2
HNO3
K2SO4
C.NaNO3
H2SO4
Ba(NO3)2
D.BaCl2
HCl
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A.碳酸钾与氯化镁反应生成碳酸镁沉淀,加入硝酸反应生成硝酸镁溶液,加入硫酸钾不反应,故A错误;
B.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入硝酸反应生成硝酸钡溶液,加入硫酸钾生成硫酸钡沉淀,故B正确;
C.碳酸钾与硝酸钾不反应,故C错误;
D.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入盐酸反应生成氯化钡溶液,加入氯化钙不反应,故D错误.
故选B.
本题解析:
本题难度:一般
3、实验题 (6分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
(2)滴定结果如下表所示:
滴定
次数
| 待测溶液的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 0.20
| 20.20
|
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
参考答案:(6分,每空2分) ①偏高 ②无影响 (2)18.85%
本题解析:略
本题难度:一般
4、选择题 按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是?(?)
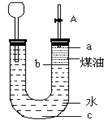
A.
 打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的 实验现象是钠在b处液面以下的水中反应
实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
参考答案:C
本题解析:略
本题难度:一般
5、选择题 对下列实验过程的评价,正确的是(?)
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,证明一定含有SO42-
C.某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+
D.验证某不纯的烧碱溶液中是否含Cl-,先加过量的稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl-
参考答案:D
本题解析:略
本题难度:简单