1、填空题
|
PCl5的热分解反应如下: 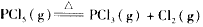
(1)写出反应的平衡常数表达式_____________________________;
(2)已知某温度下,在容积为10.0L的密闭容器中充人2.00 mol PC15,达到平衡 后,测得容器内PC13的浓度为0.150 mol/L。计算该温度下的平衡常数。___________________________________
参考答案:(1)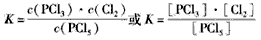
(2)
本题解析:
本题难度:一般
2、填空题 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a?mol?CO2和a?mol?H2,测得不同时刻的c(H2)如右表.
| 时间/min | C(H2)/mol.L-1
0
0.40
2
0.28
4
0.19
6
0.13
8
0.08
10
0.04
12
0.04
|
(1)写出生成CH3OH反应的化学方程式:______.若达平衡状态时,放出的热量为58.8kJ,则上述反应的△H=______.0~10min内,CH3OH的平均反应速率v(CH3OH)=______.
(2)下列措施能使平衡体系中增大的是______(填字母).
A、升高温度?B、充入Ar使压强增大
C、再充入0.5a?mol?CO2和0.5a?mol?H2D、将水从平衡体系中分离出来
(3)a=______,该温度下上述反应的平衡常数K=______(精确到0.1).
(4)在如图所示的坐标系中,画出CO2和H2的浓度随时间变化的图象.
参考答案:(1)CO2(g)与H2(g)反应生成CH3OH(g)和H2O(g).由表中数据可知10min起氢气的浓度不再变化,且不为0,所以为可逆反应.反应方程式为CO2+3H2
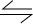
CH3OH+H2O.
由表中数据可知氢气的起始浓度为0.40mol/L,平衡浓度为0.04mol/L,所以参加反应的氢气的物质的量为
(0.40mol/L-0.04mol/L)×10L=3.6mol,所以3mol氢气反应放出的热量为3mol3.6mol×58.8kJ=49kJ,所以则上述反应的CO2+3H2

CH3OH+H2O的反应热△H=-49kJ/mol.
由表中数据可知10min内△c(H2)=0.40mol/L-0.04mol/L=0.36mol/L,所以v(H2)=0.36mol/L10min=0.036mol/(L?min).
速率之比等于化学计量数之比,所以v(CH3OH)=13v(H2)=13×0.036mol/(L?min)=0.012mol/(L?min),
故答案为:CO2+3H2

CH3OH+H2O;-49kJ/mol;0.012mol/(L?min);
(2)A、该反应为放热反应,升高温度,平衡向逆反应方向移动,c(CH3OH)减小,c(CO2)增大,所以c(CH3OH)c(CO2)减小,故A错误;
B、充入Ar使压强增大,体积不变,反应混合气体浓度不变,平衡不移动.所以c(CH3OH)c(CO2)不变,故B错误;
C、等效为开始充入1.5a?mol?CO2和1.5a?mol?H2,体积变为原来1.5倍,平衡后再将体积压缩为原来体积.增大压强平衡向体积减小的方向移动,即向正反应移动,c(CH3OH)增大,c(CO2)减小,所以c(CH3OH)c(CO2)增大,故C正确;
D、将水从平衡体系中分离出来,生成物的浓度降低,平衡向正反应移动.c(CH3OH)增大,c(CO2)减小,所以c(CH3OH)c(CO2)增大,故D正确.
故选:CD;
(3)由表中数据可知氢气的起始浓度为0.40mol/L,所以a=0.40mol/L×10L=4mol.
根据三段式求出各组分的浓度变化量、平衡时各组分的浓度,
由表中数据可知氢气的起始浓度为0.40mol/L,所以二氧化碳的起始浓度也为0.40mol/L,平衡时氢气浓度为0.04mol/L,
?对于反应? CO2(g)+3H2(g)

CH3OH(g)+H2O(g)
开始(mol/L):0.4? 0.4? 0? 0
变化(mol/L):0.12?0.4-0.04=0.36? 0.12? 0.12
平衡(mol/L):0.28?0.04? 0.12? 0.12
所以平衡常数k=c(CH3OH)?c(H2O)c(CO2)?c3(H2)=0.12×0.120.28×0.043=803.6,
故答案为:4mol;803.6;
(4)由(3)计算可知,二氧化碳、氢气的起始浓度为0.40mol/L.氢气的平衡浓度为0.04mol/L,二氧化碳的平衡浓度为0.28mol/L.
由方程式 CO2(g)+3H2(g)

CH3OH(g)+H2O(g)可知,相同时间内H2的浓度变化是CO2浓度变化的3倍,再根据表中氢气各时刻的浓度,计算二氧化碳的各时刻浓度.
作图如图所示:

,故答案为:

.
本题解析:
本题难度:一般
3、选择题 合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是( )
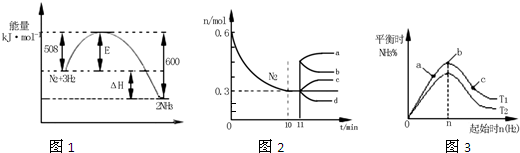
A.由图1可知2NH3(g)N2(g)+3H2(g)△H=-92kJ?mol-1
B.图2中0~10min内该反应的平均速率v(H2)=0.045mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
参考答案:B
本题解析:
本题难度:一般
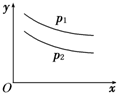
4、选择题 反应L(s)+aG(g)

bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
A.上述反应正方向是放热反应
B.上述反应正方向是吸热反应
C.a>b
D.a+1<b