| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《难溶电解质的溶解平衡》考点预测(2019年强化版)(十)
参考答案:B 本题解析:足量的AgCl加入水中,形成饱和溶液,存在AgCl的溶解平衡,当氯离子的浓度越大时,银离子的浓度越小。A中的氯离子的浓度是0.4mol/L,B中氯离子的浓度是0.6mol/L,C中的氯离子的浓度是0.5mol/L,D中氯离子的浓度是0.3mol/L,氯离子浓度最大的是B,所以银离子浓度最小的为B,答案选B。 本题难度:一般 2、选择题 氢氧化镁悬浊液存在下列平衡:Mg(OH)2 参考答案:C 本题解析: 本题难度:一般 3、选择题 已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,MgF2的溶度积常数Ksp = 7.4×10-11。下列说法正确的是 参考答案:A 本题解析: 本题难度:简单 4、选择题 室温时,M(OH)2(s) |
参考答案:C
本题解析:Ksp=c(M2+)?c2(OH-)=a;由于c(M2+)="b" mol/L,所以c2(OH-)=a/b,c(OH-)=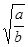 ,c(H+)=Kw÷c(OH-)=10-14
,c(H+)=Kw÷c(OH-)=10-14 ;所以pH=-lg10-14
;所以pH=-lg10-14 =14+
=14+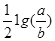 ;故选项是C。
;故选项是C。
考点:考查沉淀溶解平衡常数的应用、溶液的pH的计算的知识。
本题难度:一般
5、填空题 (12分)某湖泊底部为石灰石(CaCO3)质,假设湖水中只溶有少量CO2。
⑴写出CaCO3的溶解平衡平衡表达式: 。
⑵当大气中CO2含量升高时,CaCO3可能发生的变化是 (用化学方程式表示)。
| 实验编号 | c(NaOH)mol/L | V(NaOH)mL | V(强酸)mL |
| 1 | 0.1154 | 25.72 | 25.09 |
| 2 | 0.1154 | 26.70 | 25.00 |
| 3 | 0.1154 | 26.79 | 25.09 |
| 4 | 0.1154 | 26.71 | 25.00 |
参考答案:(12分)
(1)CaCO3(s)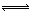 Ca2+(aq)+CO32?(ag)
Ca2+(aq)+CO32?(ag)
(2)CaCO3+H2O+CO2=Ca(HCO3)2
(3)2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)Al(OH)3,在弱酸性条件下氧化铝溶解为铝离子,Al3++3H2O 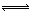 Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
Al(OH)3+3H+,氢氧化铝沉积在鱼鳃表面形成粘膜。
(5)0.1232 本题每空2分
本题解析:(1)少量CaCO3固体溶解得到Ca2+和CO32?,所以表达式为:CaCO3(s)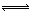 Ca2+(aq)+CO32?(ag)
Ca2+(aq)+CO32?(ag)
(2)多元弱酸和其正盐反应生成酸式盐,所以当大气中CO2含量升高时,CO2、H2O与CaCO3发生反应,生成Ca(HCO3)2,化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2
(3)H2SO3的K1、K2均大于H2CO3的K2,H2SO3的K2小于H2CO3的K1,所以SO2、H2O与CaCO3反应生成Ca(HCO3)2和CaSO3,化学方程式为:2CaCO3+H2O+SO2=Ca(HCO3)2+CaSO3
(4)花岗岩的成分含有Al2O3,当湖水的pH降低到5.0时,为弱酸性,Al2O3与H+反应生成Al3+,Al3+能发生水解反应:Al3++3H2O 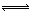 Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
Al(OH)3+3H+,生成的氢氧化铝沉积在鱼鳃表面形成粘膜,所以鱼鳃表面形成粘膜的成分为Al(OH)3。
(5)第一组数据与其它数据相差较大,实验出现了操作错误,应舍去,由2、3.4求出H+浓度的平均值,为0.1232mol/L
考点:本题考查方程式的书写、盐类水解的应用、实验数据的处理。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《气体的净化.. | |