| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《水的电离平衡》考点巩固(2019年最新版)(二)
参考答案:C 本题解析:由图可知x为强酸,y为弱酸;在PH相同且体积相同的情况下,弱酸y的物质的量比x多,消耗NaOH的物质的量更多,所以正确选项为C; 本题难度:一般 2、选择题 一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.100 0 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为 |
参考答案:B
本题解析:根据10[KHC2O4?H2C2O4]+8KMnO4+17H2SO4
本题难度:一般
3、选择题 下列电离方程式中,正确的是( )
A.HClO4═H++ClO4-
B.H2CO3?2H++CO32-
C.H2PO4-+H2O═HPO42-+H3O+
D.NH3?H2O═NH4++OH-
参考答案:A
本题解析:
本题难度:简单
4、填空题 (1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
(5)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
参考答案:(1)碱性,>; (2)酸性,<;
(3)中性,>; (4)<,>。 (5)>
本题解析:(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,得到醋酸钠溶液,醋酸根离子水解,使溶液成碱性;所以钠离子的浓度大于醋酸根离子的浓度;
(2)pH=3的醋酸和pH=11的氢氧化钠溶液中氢离子的浓度等于氢氧根离子的浓度,但醋酸是弱酸,所以醋酸溶液的浓度大于氢氧化钠溶液的浓度,等体积混合时醋酸过量,则溶液呈酸性;因为醋酸过量,溶液呈酸性,所以c(Na+)<c(CH3COO-);
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒定律,则c(OH-)= c(H+),所以溶液呈中性;若二者等体积混合,则溶液呈碱性,所以呈中性时,醋酸稍多,则醋酸体积>氢氧化钠溶液的体积;
(4)醋酸与氢氧化钠混合后溶液呈中性,若氢离子的浓度与氢氧根离子的浓度相等,则等体积混合时,醋酸过量,所以溶液呈酸性,现在溶液呈中性,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-);若溶液的浓度相等,则溶液呈碱性,所以等体积混合时,醋酸的浓度大于氢氧化钠的浓度,m>n;
(5)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,若稀释倍数相同,因为氨水中还存在电离平衡,则稀释相同倍数后,氨水的pH>氢氧化钠溶液;现在稀释后两溶液的pH仍相同,所以氨水需再加水稀释,则氨水的稀释倍数m>氢氧化钠溶液的稀释倍数n。
考点:考查溶液的浓度、离子浓度、pH之间关系的判断,溶液稀释的判断
本题难度:困难
5、填空题 已知水在25℃和95℃时,其电离平衡曲线如图所示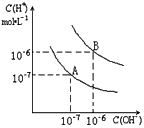
(1)则25℃时水的电离平衡曲线应为_____(填“A”或“B”),请说明理由_____________________
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______________
(3)95℃时,0.1mol/L的NaOH溶液的PH为____________
(4)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后,溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是__________________
参考答案:(1)A;25℃时,Kw=10-14
(2)10:1
(3)11
(4)a+b=14
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的分类.. | |