|
|
|
高中化学知识点总结《水的电离平衡》考点巩固(2019年最新版)(三)
2019-06-28 21:15:34
【 大 中 小】
|
1、选择题 下列叙述正确的是

[? ]
A.室温下,pH=9的氨水和pH=9的NaF溶液中,水的电离程度相同
B.2SO2(g)+O2(g)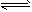 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
C.NH3+HCl=NH4Cl在任何条件下都能自发进行
D.乙酸乙酯中的少量乙酸可用饱和NaOH溶液除去
2、选择题 醋酸水溶液中的PH为2时,该溶液中C(OH—)是 ( )
A.1×10-7 mol·L-1
B.1×10-2mol·L-1
C.1×10-14 mol·L-1
D.1×10-12 mol·L-1
|
3、选择题 下列叙述正确的是
A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小
C.在0.1 mol·L-1 CH3COONa溶液中,c(OH-)>c(CH3COOH)+c(H+)
D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
|
4、选择题 下列说法中不正确的是( )
A.将纯水加热至高温度,水的离子积变大,pH减小,呈中性
B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+)>c(H+)
C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:1
D.对于酸性废水和碱性废水一般可以采用中和法处理,对于高浓度的酸、碱废水,应优先考虑回收利用
5、填空题 (1)某温度时,水的离子积KW=1×10-13,则该温度 25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol/L,则该溶液的pH可能为 。
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和。此溶液中各种离子的浓度由大到小的排列顺序是: 。