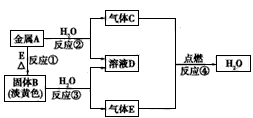
1、推断题 A、B、C、D、E五种物质之间有下图所示的转化关系。已知:A是第三周期的金属单质,其焰色反应呈黄色;C、E是非金属气体单质,且E能使带火星的木条复燃,C是密度最小的气体。
请回答:
(1)金属A是___,气体C是____。
(2)反应④的化学反应类型是___反应(填“化合”“分解”“置换”或“复分解”)。
(3)反应③的化学方程式是____。
参考答案:(1) Na或钠; H2或氢气
(2)化合
(3)2Na2O2+2H2O==4NaOH+O2↑
本题解析:
本题难度:一般
2、填空题 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:

(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色气体。则实验室常用的制取A的化学方程式为?,A转化为B的化学方程式为?。
(2)若组成D单质的元素在地壳中含量最高,A元素焰色反应为黄色,则C的电子式为?。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(只用离子方程式说明)________________,A与D反应的化学方程式是?。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为?。
(5)若D为一种强碱,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为?。
参考答案:(1)2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑? 4NH3+5O2
CaCl2+2H2O+2NH3↑? 4NH3+5O2 4NO+6H2O
4NO+6H2O
(2) ?(3)2Fe3++Fe=3Fe2+? 2Fe+3Cl2
?(3)2Fe3++Fe=3Fe2+? 2Fe+3Cl2 2FeCl3
2FeCl3
(4)CO2+CO32-+H2O=2HCO3-?(5)AlO2-
本题解析:(1)A能使湿润的红色石蕊试纸变蓝,则A是氨气。C为红棕色气体,则C是NO2。所以D是氧气,B是NO。
(2)地壳中含量最高的元素是氧,即D是O。A元素焰色反应为黄色,则A是钠,B是氧化钠,C是过氧化钠,含有离子键和非极性键。
(3)根据转化可知,若D是金属,则应是变价金属,因此D是Fe。所以A是氯气,B是氯化铁,C是氯化亚铁,氯化亚铁易被氧化,所以要加入铁,防止氧化。
(4)温室气体是CO2,即D是CO2,A是氢氧化钠,B是碳酸钠,C是碳酸氢钠。
(5)D为一种强碱,B具有两性,则A是铝盐,B是氢氧化铝,C是偏铝酸盐。
本题难度:一般
3、填空题 X、Y、Z、W是原子序数依次增大的短周期元素,互不同族,其中只有两种为金属元素;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。Y和W的单质都能与NaOH溶液反应。请回答下列问题:
(1)X元素的名称是_________,Y、Z、W的原子半径由小到大的顺序是________(用元素符号表示)。
(2)W元素在周期表中的位置是__________,Y元素的原子结构示意图是___________。
(3)Z和W在一定条件下能形成化合物ZW2,分子中各原子均达到了8电子稳定结构,则ZW2的电子式是_______;它在常温下呈液态,形成晶体时,属于________晶体。
(4)X的单质与Y的单质化学性质相似,则X的单质与NaOH溶液反应的离子方程式是_______________(注:生成物中,含有X元素的化合物的化学式中含有2个氧原子)
(5)0.1mol W的单质与50 mL 1.5 mol·L-1的FeBr2溶液反应,被氧化的Fe2+和Br-的物质的量之比是____________。
参考答案:
(1)铍(1分);Cl<S<Al(2分)
(2)第三周期ⅦA族; (各2分)
(各2分)
(3)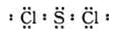 (2分);分子(1分)
(2分);分子(1分)
(4)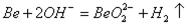 (2分)
(2分)
(5)3︰5(3分)
本题解析:略
本题难度:一般
4、填空题 位于短周期且原子序数依次增大的B、D、C三种元素与另一种元素A的单质,甲、乙、丙、丁四种常见的化合物,有如下图所示的转化关系:
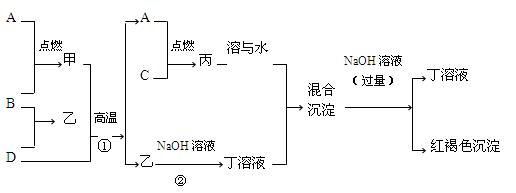
①B、C的单质是常见气体;A、D的单质是常见固体且均能与稀酸反应。
②甲是黑色固体;反应①的原理可用于冶金工业;乙具有很高的熔点,是工业制取D单质的原料。
试根据上图和题中有关叙述推断回答:
⑴写出化合物甲的化学式_________________;
⑵写出反应②的化学方程式______________________________________________;
⑶实验室中用MnO2作为试剂之一制取C单质的离子方程式_________;
⑷在丁溶液中逐滴滴加稀盐酸直到过量,出现的实验现象是:
______________________________________________________________________,有关的离子方程式为___________________________________________。
参考答案:⑴Fe3O4;? ⑵Al2O3+2NaOH=2NaAlO2+H2O;
⑶MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
⑷开始时产生白色沉淀,盐酸过量后沉淀消失变澄清;
AlO2-+H++H2O=Al(OH)3↓? Al(OH)3+3H+=Al3++3H2O。
本题解析:略
本题难度:一般
5、填空题 (14分)A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如下图所示的转化关系:
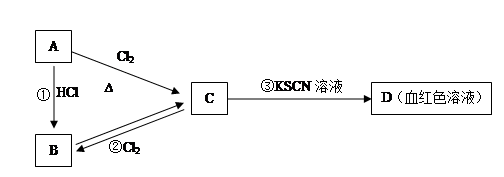
试回答下列问题:
(1)A是?,C是?
(2)B的溶液与NaOH溶液混合的现象是?,相应的化学方程式为?、?。?
(3)反应①的反应类型是?反应(选填“化合”、“分解”、“置换” “复分解”)。
(4)写出反应②的离子方程式?。
参考答案:(1)? Fe? FeCl3
(2)产生白色絮状沉淀,沉淀迅速变为灰绿色,最后变为红褐色。
FeCl2 +NaOH=" Fe" (OH)2↓+2NaCl? Fe (OH)2 +O2 +2H2O =" 4Fe" (OH)3
(3) 置换? (4)? 2Fe 2+ + Cl2= 2Fe3+ +2 Cl-
本题解析:本题是无机框图题,关键是找准突破点。D显血红色,说明C中含有铁离子,即C是氯化铁,则A是铁,和盐酸发生置换反应生成B和氢气,则B是氯化亚铁。
本题难度:一般