1、填空题 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
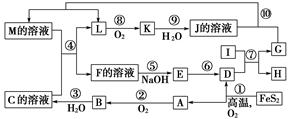
提示:4FeS2+11O2高温,2Fe2O3+8SO2
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第________周期________族。
(2)在反应⑦中氧化剂与还原剂的物质的量之比为________。
(3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。
(4)反应④的离子方程式是_____________________________________。
(5)将化合物D与KNO3、KOH共熔,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是________________________。
参考答案:(1)四 Ⅷ
(2)1∶2
(3)③
(4)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
本题解析:该题推断的突破口是反应①,根据“提示”可知D、A分别是Fe2O3、SO2;根据题中叙述信息,可知I为Al,K为NO2,再根据框图信息可以推断出B为SO3,C为硫酸,E为Fe(OH)3,F的溶液中含Fe3+,G为Fe,H为氧化铝,J为硝酸,L为NO,M的溶液中含Fe2+。
本题难度:困难
2、选择题 能实现下列物质间直接转化的元素是( )
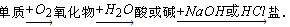
A.硅
B.硫
C.铜
D.铁
参考答案:B
本题解析:
本题难度:简单
3、填空题 (如图表示常见元素单质及化合物相应关系,某些生成物略去
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分
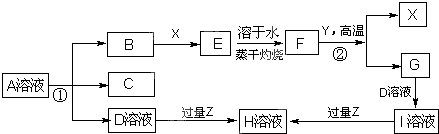
请回答下列问题:
(1)D的电子式______;H为______(填化学式)
(2)完成下列方程式
空气中含量最高的气体与C反应的化学反应方程式______;
反应②的化学反应方程式______;
足量B通入H溶液的离子反应方程式______.
参考答案:反应①为氯碱工业的基础反应,D为NaOH,B为Cl2,C为H2,结合转化关系中的反应条件和反应特征可知,F何Y金属反应生成X金属,X、Y为常见金属,判断为铝热反应,X为Fe,E为FeCl3,F为Fe2O3,Y为Al,G为Al2O3 I为NaAlO2;Z为形成酸雨的主要成分为SO2,H为NaHSO3,
(1)D为NaOH电子式为:
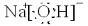
,H为NaHSO3,故答案为:
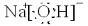
;NaHSO3;
(2)空气中含量最高的气体为N2与C(H2)反应的化学反应方程式为:N2+3H2催化剂.高温高压2NH3;
反应②为铝和氧化铁发生的铝热反应,反应的化学反应方程式为:2Al+Fe2O3?高温?.?2Fe+Al2O3;
足量B(Cl2)通入H(NaHSO3)溶液中发生氧化还原反应,反应的离子反应方程式:Cl2+HSO3-+H2O=2Cl-+SO42-+3H+,
故答案为:N2+3H2催化剂.高温高压2NH3 ;2Al+Fe2O3?高温?.?2Fe+Al2O3;Cl2+HSO3-+H2O=2Cl-+SO42-+3H+.
本题解析:
本题难度:简单
4、填空题 (9分)有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:①X与Z、Y与W分别同主族;②X、Z、W分别与Y都能形成两种常见的化合物;③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
(1)写出由Y与Z形成的化合物Z2Y2的电子式:?,WY2与X2Y2反应生成粘稠油状液体的化学方程式:?。
(2)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为:?。
(3)X、Y两种元素的单质已经被应用于飞船的燃料电池中,如图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
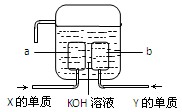
①a是装置的?极。
②b极上的电极反应式是?。
参考答案:(9分)
⑴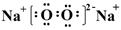 ? H2O2 + SO2 = H2SO4
? H2O2 + SO2 = H2SO4
⑵H+ + HSO3— = H2O + SO2↑
⑶负(1分)? O2 + 2H2O + 4e— = 4OH—
本题解析:X、Z、W分别与Y都能形成两种常见的化合物是本题推断元素的主要突破点:这两种常见的化合物分别为H2O、H2O2、Na2O、Na2O2。所以四种元素分别为:H、O、Na、S。
(3)组成了氢氧碱性燃烧电池,其中通入氢气的一方为负极,失电子:H2 +2e—+2OH— = 2H2O!通往氧气的一方为正极,得电子:O2 + 2H2O + 4e— = 4OH—;
本题难度:一般
5、推断题 已知M是无色液体,C、H、D是有刺激性气味的气体,且D是单质,E为三原子非极性分子,②是工业上制取F的反应,J为漂白粉的有效成份。(部分反应条件未列出)
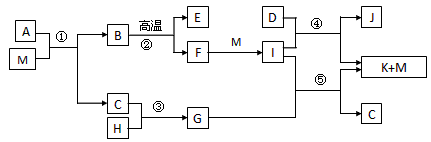
请回答下列问题:
(1)E、D、J的化学式分别是___________、___________、___________,G的电子式___________
(2)反应④的化学方程式______________________
(3)简述C的一种用途:___________
(4)A由三种元素组成,1mol A与M反应可生成1mol B和2mol C,则A的化学式是___________
(5)漂白粉常用作消毒剂、杀菌剂、漂白剂等。漂白粉是一种混合物,漂白粉质量高低由"有效氯"(过量酸与漂白粉作用生成的氯气的质量与漂白粉的质量比)决定。漂白粉样品2.00克,加水研磨后,转入250毫升容量瓶内,用水稀释至刻度,摇匀后,取出25.0毫升,加入过量的KI溶液和过量的稀硫酸,静置。待漂白粉放出的氯气与KI完全反应后,用0.100摩/升的Na2S2O3标准溶液滴定反应中生成的碘。反应如下
2Na2S2O3+I2=Na2S4O6+2NaI滴定时用去Na2S2O3溶液20.0毫升。计算该漂白粉中有效氯的百分含量。已知漂白粉与酸的反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O
参考答案:(1)CO2;Cl2;Ca(ClO)2; ?
?
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3)制硝酸或化肥(4)“略”
(5)“略”
本题解析:
本题难度:一般