1、简答题 甲、乙、丙、丁是由短周期元素组成的物质,反应如下:甲+乙→丙+丁
(1)若甲为块状固体,丙分子内同时具有极性键和非极性键可燃性气体,乙为水,则丙的结构式______.
(2)若甲和丁是同主族元素组成的单质,乙为水.且甲的组成元素位于第三周期,反应的离子方程式______.
(3)霍夫曼用上述反应测定了氨分子的组成.用图3装置实验,打开分液漏斗活塞,滴下浓氨水至不再反应为止;关闭活塞,待恢复至室温,打开止水夹,试管内液面上升至
处.滴加浓氨水后试管内的现象:______反应化学方程式:______
(4)若甲Cl2,乙为NH4Cl反应,丁为HCl,丙为氮的氯化物,当消耗6.72L?Cl2(标状)时得到0.10mol氮的氯化物,丙的化学式______,反应方程式______.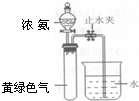
参考答案:(1)丙分子内同时具有极性键和非极性键可燃性气体,应为C2H2,为直线形分子,结构式为H-C≡C-H,故答案为:H-C≡C-H;
(2)甲和丁是同主族元素组成的单质,乙为水,发生置换反应,生成气体为H2或O2,甲的组成元素位于第三周期,只有
Na与水反应生成H2符合,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)打开止水夹,试管内液面上升至23处,说明生成气体为原来气体的13,即n(Cl2):n(N2)=3:1,则反应的方程式为
8NH3+3Cl2=N2+6NH4Cl,随着反应的进行,黄绿色气体逐渐消失,并生成大量白烟,
故答案为:产生大量白烟,黄绿色气体消失;8NH3+3Cl2=N2+6NH4Cl;
(4)n(Cl2)=6.72L22.4L/mol=0.3mol,氮的氯化物为0.1mol,设生成物的化合价为x,根据氧化剂和还原剂得失电子数目相等,则有0.3mol×2=0.1mol×[x-(-3)],x=3,所以生成物为NCl3,反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,
故答案为:NCl3;3Cl2+NH4Cl═NCl3+4HCl.
本题解析:
本题难度:一般
2、简答题 有X、Y、A三种单质,其中X单质在常温、常压下为气体,Y单质为固体.
①纯净的氢气可在X单质中燃烧产生苍白色的火焰和大量的白雾;
②Y单质在空气中剧烈燃烧,发出黄色的火焰,生成一种淡黄色的固体;
③A经如图所示的过程转化为含氧酸D,已知D为强酸

根据上述实验现象或事实进行推断:
(一)写出X单质与水反应的化学方程式:______.
(二)写出Y单质与氧气在常温下反应的化学方程式:______.
(三).(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①D的化学式是______.
②在工业生产中B气体的大量排放被雨水吸收后形成了______而污染了环境.
(2)若A在常温下为气体,C是红棕色的气体
①A、C的化学式分别是:A______C______.
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式______.
参考答案:有X、Y、A三种单质,其中X单质在常温、常压下为气体,Y单质为固体.
①纯净的氢气可在X单质中燃烧产生苍白色的火焰和大量的白雾,应是氢气与氯气的反应,则X为Cl2;
②Y单质在空气中剧烈燃烧,发出黄色的火焰,生成一种淡黄色的固体,含有Na元素,则Y为Na;
(一)氯气与水反应生成HCl与HClO,反应的化学方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;
(二)Na与氧气在常温下反应生成Na2O,反应的化学方程式为:4Na+O2=2Na2O,
故答案为:4Na+O2=2Na2O;
(三)A经如图所示的过程转化为含氧酸D,已知D为强酸:
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则B为SO2,可推知A为S、C为SO3、D为H2SO4,在工业生产中SO2气体的大量排放被雨水吸收后形成了亚硫酸而污染了环境,
故答案为:H2SO4;亚硫酸;
(2)若A在常温下为气体,C是红棕色的气体,则C为NO2,可推知A为NH3,B为NO,D为HNO3,浓硝酸在常温下可与铜反应生成NO2气体与硝酸铜、水,该反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
故答案为:①NH3;NO2;②Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
本题解析:
本题难度:一般
3、填空题 (8分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
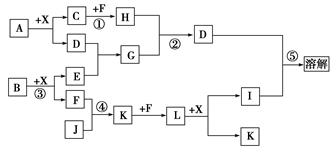
(1)写出化学式:A________,B________,J________。
(2)反应③中每生成1 mol F,转移电子的数目为______________。
(3)反应④的化学方程式为:______________________________。
(4)写出离子方程式:
反应②_______________________________________________;
反应⑤________________________________________________。
(5)反应①中,每1.00 g C与足量的F作用,恢复到25 ℃放出55.6 kJ热量,写出
反应①的热化学方程式??。
参考答案:

本题解析:略
本题难度:一般
4、填空题 (11分)、A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
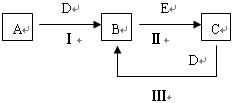
⑴若 A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式?;
A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式?;
②写出反应Ⅰ的化学方程式?。
⑵若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10 电子粒子
电子粒子
①写出A的电子式?
②写出反应Ⅱ的化学方程式?
⑶若A是地壳中含量最多的金属,B在火焰上灼烧时火焰呈黄色,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀
①写出B的化学式?②写出反应Ⅲ的离子方程式?
⑷若A是黑色粉末,常温 下B是黄绿色气体,C溶液呈碱性,有漂白性。
下B是黄绿色气体,C溶液呈碱性,有漂白性。
写出反应Ⅲ的离子方程式?;
参考答案:(11分)、⑴①CO (1分)? ② 4NH3+5O2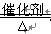 4NO+6H2O?(2分)?
4NO+6H2O?(2分)?
⑵①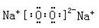 (1分)?②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (2分)
(1分)?②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (2分)
⑶ ①NaAlO2(1分) ②Al3++4OH-=AlO2-+2H2O (2分)⑷ H++Cl-+ClO-=Cl2↑+H2O(2分)
本题解析:略
本题难度:一般
5、填空题 已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
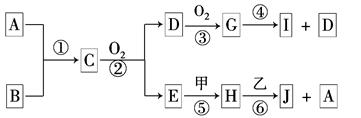
(1)写出反应②的化学方程式为_________________________________________。
(2)反应④中每消耗1 mol G,转移电子的物质的量为______________。
(3)反应⑥的离子方程式是___________________________________________。
(4)实验室中保存I的方法是____________________________。
参考答案:(1)4NH3+5O2 4NO+6H2O( 2分)
4NO+6H2O( 2分)
(2) mol( 2分)?(3)2Al+2H2O+2OH-===2AlO+3H2↑( 2分)
(4)保存在棕色试剂瓶中,放在阴凉处( 2分)
本题解析:略
本题难度:简单